2021年ASCO年会正在进行中,众多国际前沿和备受关注的临床肿瘤学科研成果及临床数据也令人振奋。医药魔方梳理总结了本次ASCO年会上的TOP10新机会,将在6月8日(18:30)进行主题直播。除此之外,也筛选了其他10项值得关注的药物最新动态及临床进展,今天分享给大家。
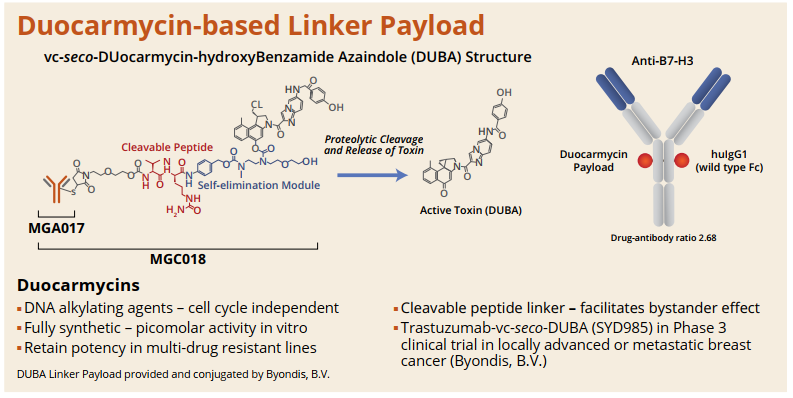
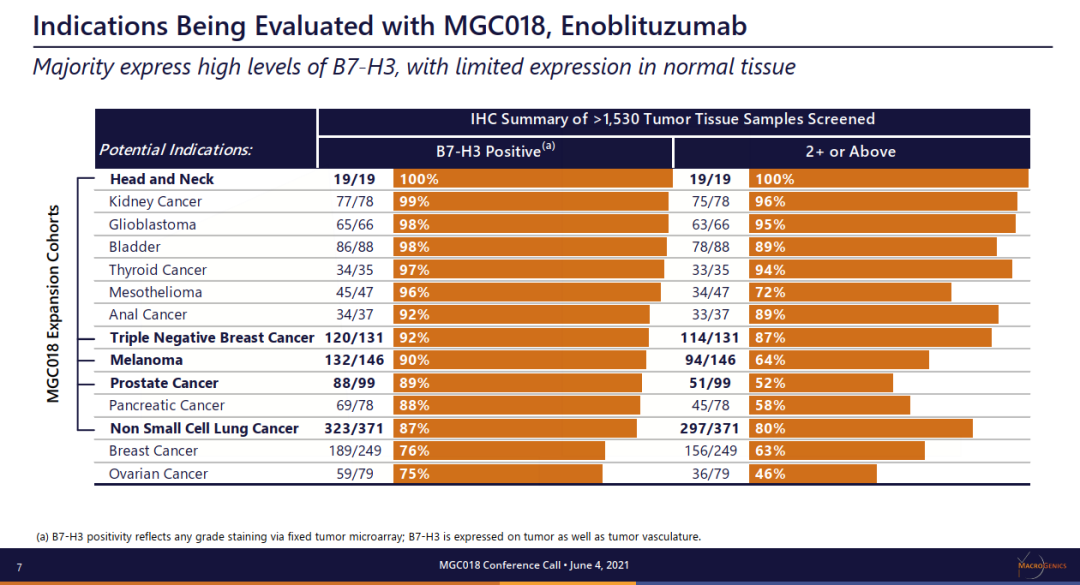
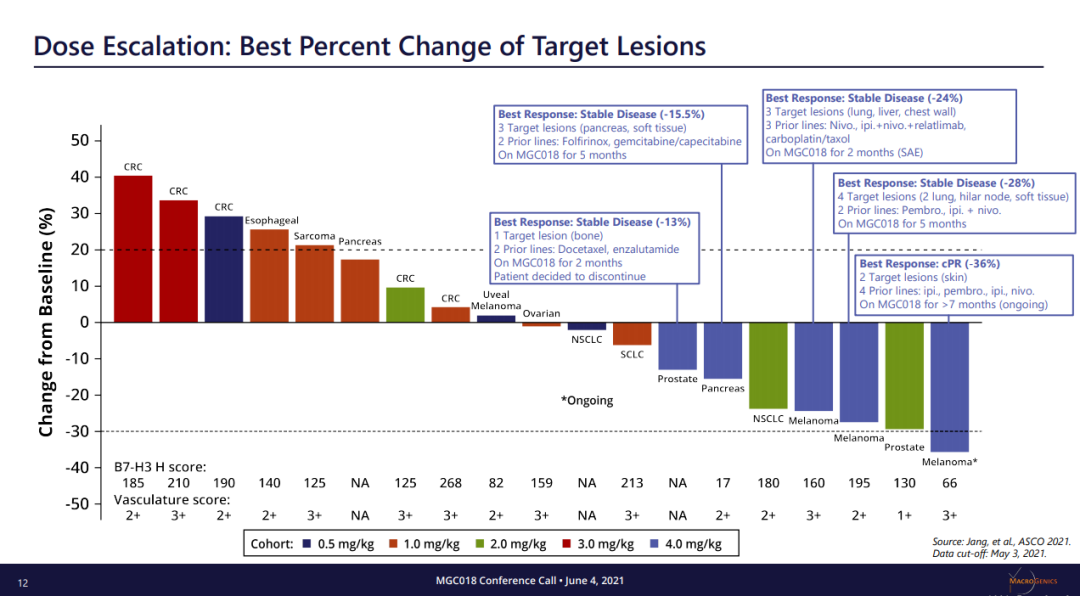
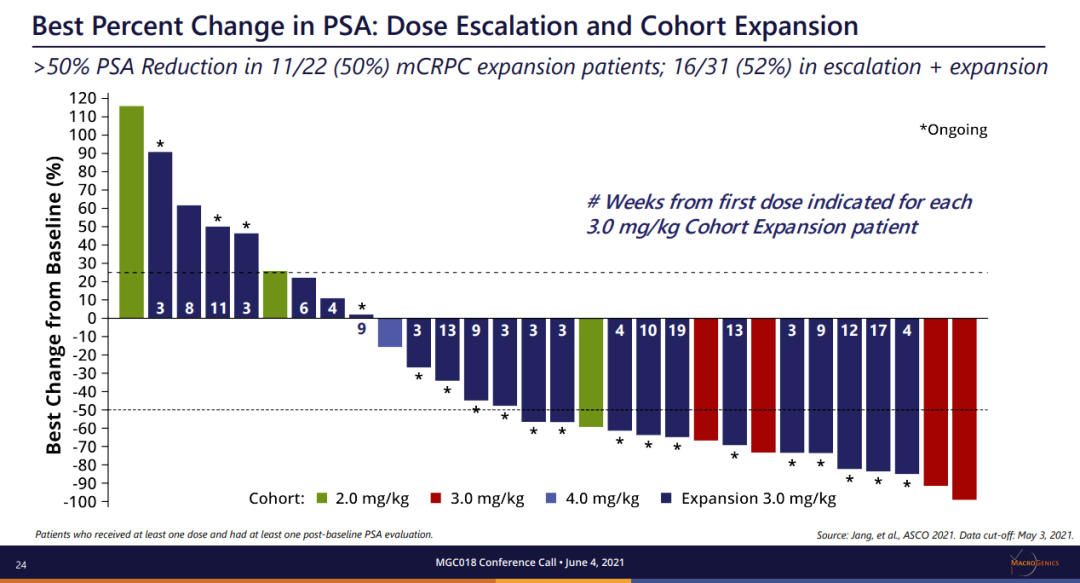
MGC018将是医药魔方在直播中为大家讲解分享的最值得关注Top10新机会之一。MGC018 是一种基于倍癌霉素靶向 B7-H3的抗体偶联药物 (ADC),由人源化靶向B7-H3的抗体与倍癌霉素DNA 烷基化有效载荷结合。B7-H3 是免疫调节分子B7家族成员,在多种实体瘤中过表达,并与疾病严重程度和不良预后相关。MGC018能够诱导免疫记忆、介导免疫调节活性并增强与检查点阻断剂联合用药的抗癌活性等临床前潜质。![]()
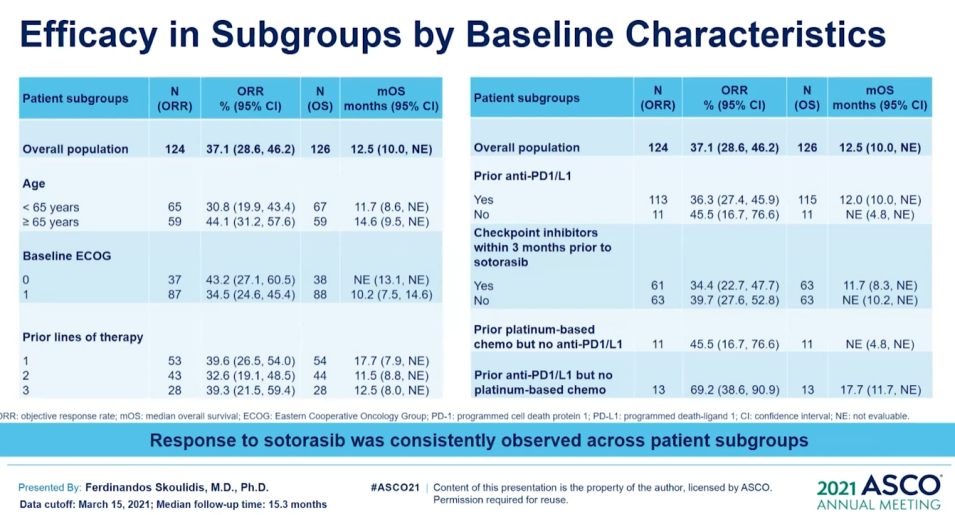
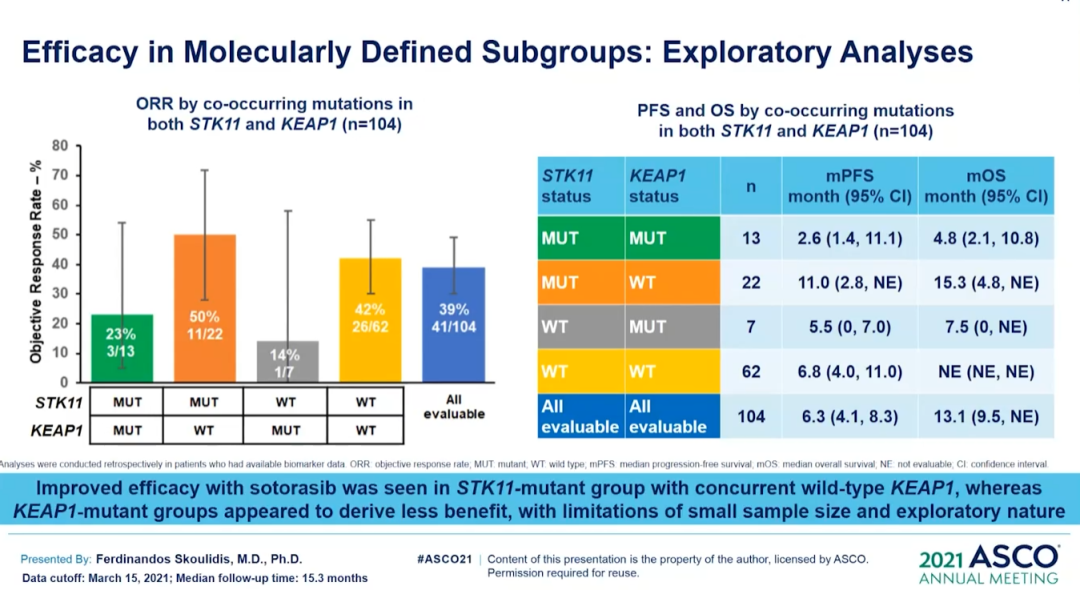
来源:Macrogenics官网本次ASCO会议,MGC018公布一项剂量递增研究,招募了覆盖多种肿瘤类型的29名患者,包括经先前接受≥2线检查点治疗的3例复发性黑色素瘤患者。采用3+3+3剂量递增设计,每3周静脉给予MGC018。结果显示了可接受的安全性,并显示对先前治疗的转移黑色瘤早期临床活性,3名黑色素瘤患者肿瘤全部缩小(24.4%、27.5%和35%),包括1例未确认的PR。并且,MGC018同样显示了针对前列腺癌的强大临床活性。在AACR2021上,对于多种头颈癌PDX模型,MGC018也显著抑制了肿瘤生长,表现出强大的抗肿瘤效果。5月28日,FDA批准Lumakras(sotorasib)用于治疗携带KRASG12C突变的非小细胞肺癌(NSCLC),迎来“不可成药”靶点KRAS的首个靶向药物里程碑。Lumakras是基于CodeBreaK100临床研究的亚组结果获得加速批准,124例先前接受免疫治疗和/或化疗后进展的KRASG12C突变阳性NSCLC患者,接受剂量960 mg的Lumakras治疗,总缓解率达到36%(95% CI:28-45),疾病控制率为81%(95% CI:73-87),中位缓解持续时间为10个月。随着获批上市,Lumakras(sotorasib)的关注度或许会降低。不过,在2021ASCO会议上,Lumakras(sotorasib)将首次披露CodeBreaK100临床Ⅱ期研究的总生存期和探索性亚组分析数据。结果显示,Lumakras治疗 KRASG12C突变NSCLC患者的mOS达到12.5个月;亚组分析结果显示,先前接受PD-1/L1治疗的患者mOS为17.7个月。但是,在一项近8万人的测序分析中,再次确证非G12C突变(G12D,G12V)占据更多的KRAS突变比例。Lumakras(sotorasib)的上市固然令人振奋,但面对这个曾经的“不可成药”靶点,仍有很多工作需要继续探索。![]()
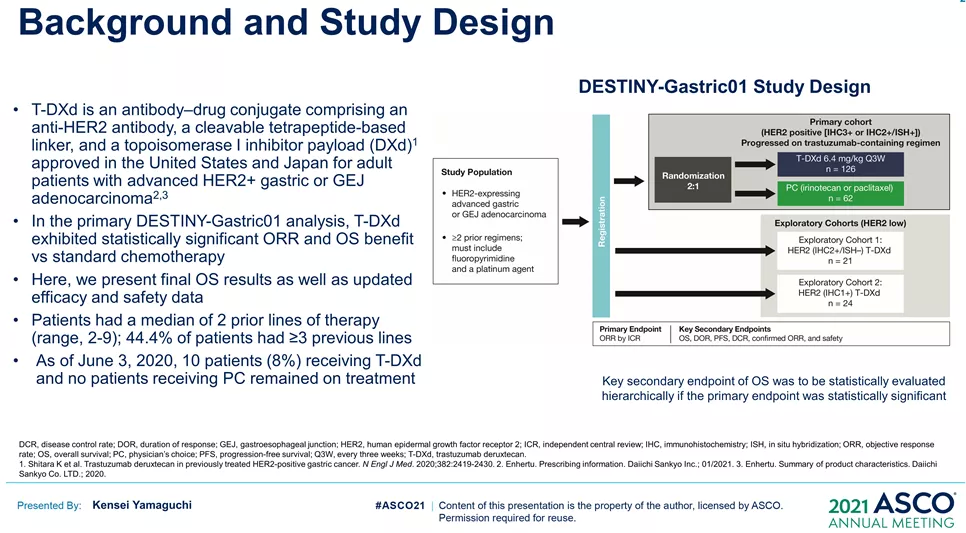
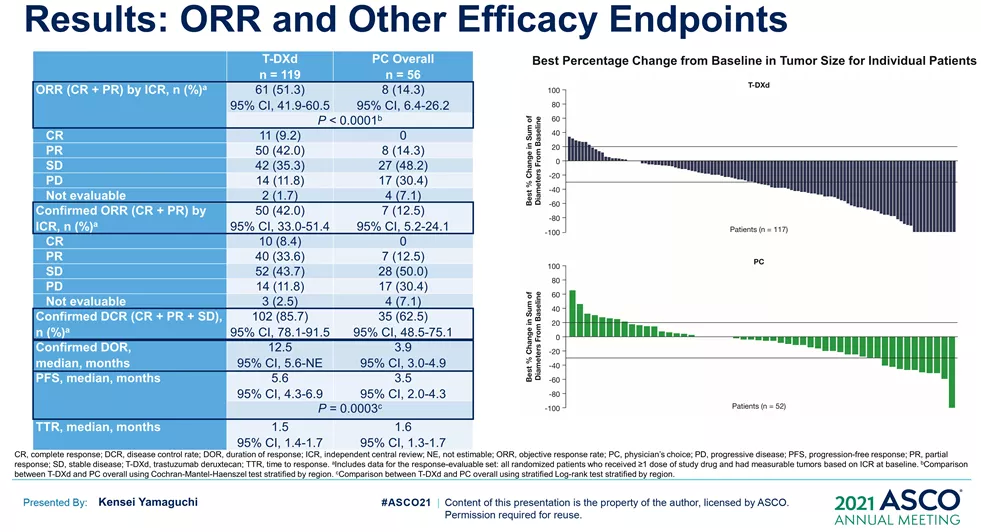
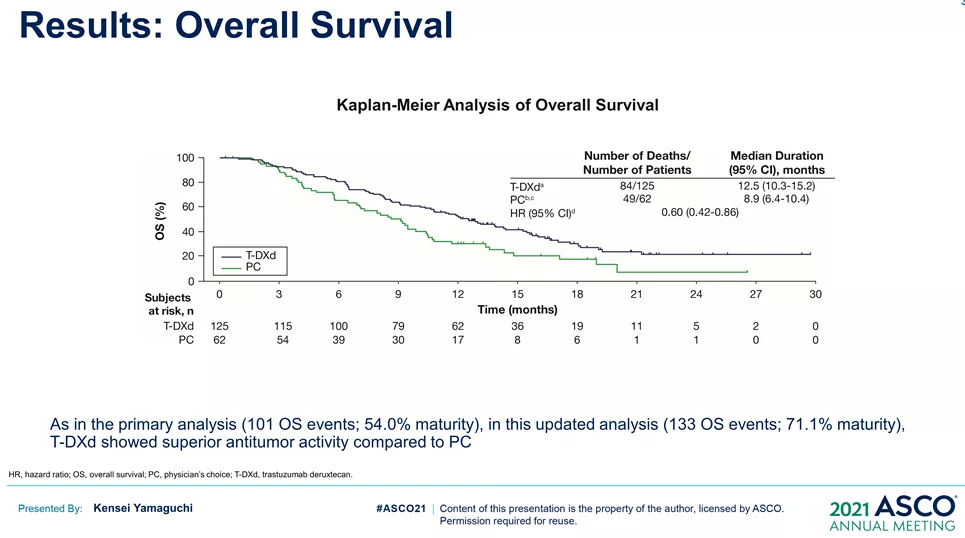
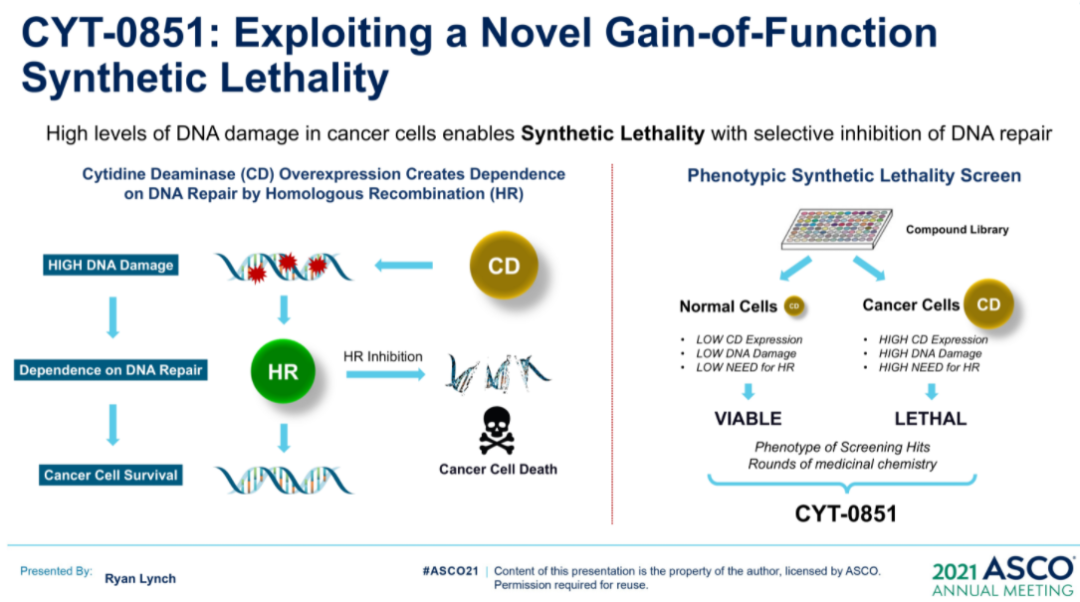
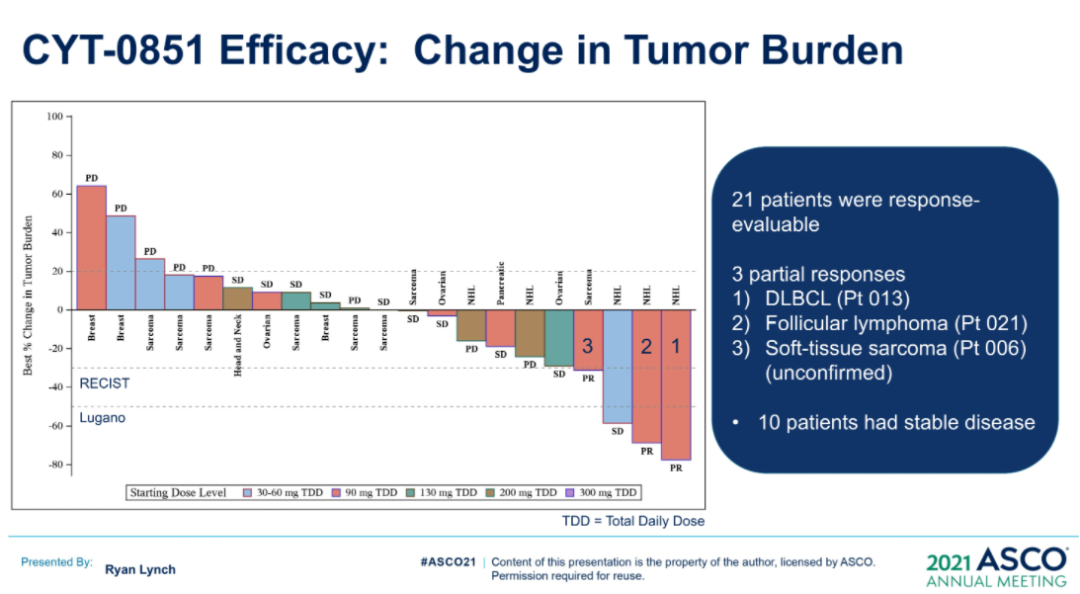
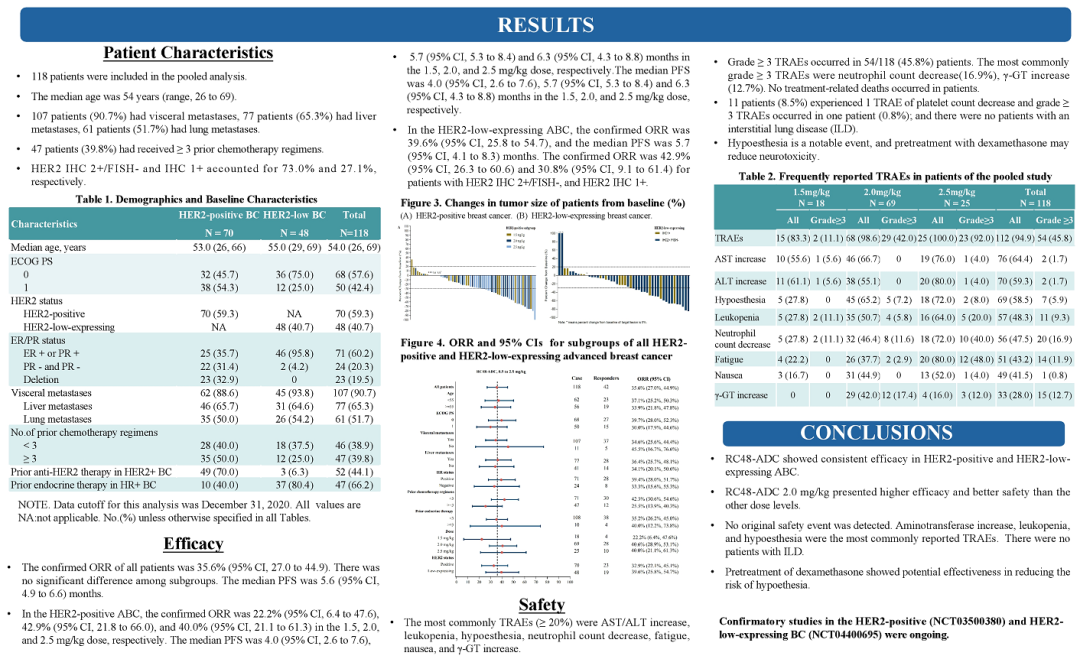
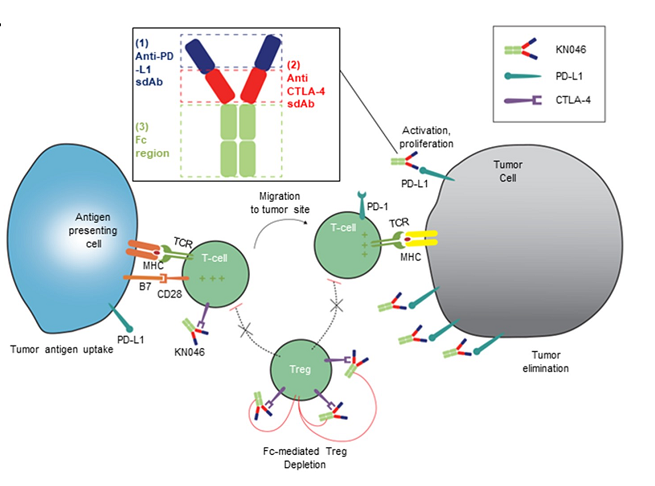
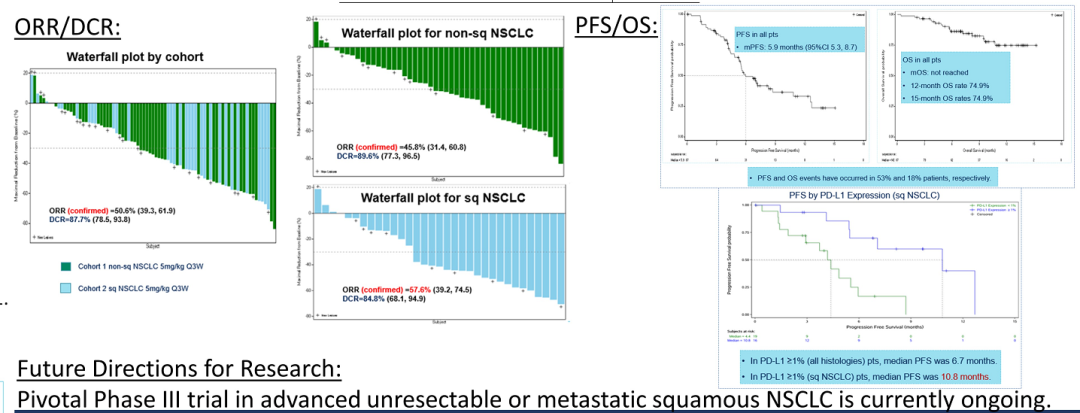
来源:ASCO20215月22日,Amivantamab同样获得FDA加速批准,成为EGFR外显子20插入突变的成年非小细胞肺癌(NSCLC)首个治疗方法。在WCLC2020会议期间,公布了针对该人群的治疗数据(Abs#3031),Amivantamab治疗ORR为40%,中位反应持续时间11.1个月。此外,Amivantamab联合EGFR-TKI三代药物lazertinib用于治疗奥希替尼复发、未接受化疗的 EGFR 突变NSCLC的研究也可关注。在45例奥希替尼治疗复发的患者中,36%有确认的反应(1个CR,15个PR)。中位随访时间8.2个月,44%(20/45)患者仍在接受治疗,69% (11/16)的响应患者持续缓解(≥6个月),mPFS为4.9个月,尚未达到中位缓解持续时间。但是,通过生物标记物分析,这些相应患者更多是基于药物机制的正常治疗作用。44患者通过ctDNA 进行评估,29例患者经NGS评估。基因检测确定了17例生物标志物阳性患者,其中8例(47%)有反应。其余 28 例患者,仅8例(29%)对治疗有相应。28名患者中,18例患者的耐药机制未知(8名PR),10例患者属于非EGFR/MET耐药机制(无应答)。生物标志物阳性和阴性患者的mPFS分别为 6.7个月(3.4-NR)和4.1个月(1.4-9.5)。9/10(90%) IHC 高(EGFR+MET H组合评分>400)患者对治疗有反应,而IHC低患者仅1/10对治疗有反应。作为全球第二款上市的CDK4/6抑制剂,Ribociclib在本次会议上更新了一线治疗绝经后HR+/HER2-转移性乳腺癌的总生存期(OS)数据。此前,MONALEESA-7研究证实了Ribociclib联合内分泌治疗的中位OS接近5年(58.7个月),创造了绝经前女性HR+/HER2-转移性乳腺癌最长OS结果。本次公布的数据是一项III 期MONALEESA-3研究(NCT02422615)探索性分析。先前数据已经表明,Ribociclib联合氟维司群较安慰剂联用氟维司群,无论一线还是二线治疗,均显著改善绝经后女性HR+/HER2−转移性乳腺癌OS(未达到 vs 40.0个月;HR,0.72;95% CI,0.57-0.92,P=.00455)。本次公布数据是额外中位16.9 个月的随访后,对 OS 进行的探索性分析。数据显示,在截止时(2020年10月30日),中位随访时间为 56.3 个月。68例(14.0% vs8.7%)患者仍在接受Ribociclib联合氟维司群的治疗。经过此次延长的随访,Ribociclib联合氟维司群继续显示OS获益(mOS:53.7vs 41.5 m;HR,0.73;95% CI,0.59-0.90)。此外,Ribociclib联合氟维司群在1L(mOS,未达到 vs 51.8m;HR,0.64;95% CI,0.46-0.88)和 2L 亚组(mOS,39.7 vs33.7 mo;HR,0.78;95)中也显示更长的OS获益。Enhertu(Trastuzumab deruxtecan,T-DXd;DS-8201)作为ADC领域的明星药物,备受关注。Enhertu不仅拓展了多种适应症领域,也走在了打破ADC药物常规“教条”征途上。其中,Enhertu的一项随机、多中心治疗 HER2 阳性晚期胃或胃食管交界处 (GEJ) 腺癌的临床Ⅱ期研究(DESTINY-Gastric01)最终OS数据公布。共纳入187例患者,几乎全部为亚洲患者(日本:79.7%,韩国:20.3%),125例接受T-DXd;患者中位接受先前2线及以上治疗,44.4%为3 线以上。在数据截止时(2020年6月3日),8%的患者仍在接受T-DXd(中位生存期随访:18.5 个月)治疗,而接受医生选择的治疗对照组(PC:伊立替康 [I] 或紫杉醇 [P])为0%。T-DXd与PC相比,OS得到改善(mOS:12.5vs 8.9 m;HR:0.60);12个月OS分别为52.2%和29.7%。T-DXd治疗的ORR为51.3%(61/119;11 CR,50 PR),而PC为14.3%(8/56;全部为PR),确认的ORR(42.0% vs12.5%)、DCR (86.6% vs 62.5%)、mDOR(12.5vs 3.9 m)、mPFS(5.6 vs 3.5 m; HR:0.47)也显著更高。除了HER2 阳性晚期胃或胃食管交界处 (GEJ) 腺癌,Enhertu也在开展针对HER2阴性的胃癌研究。作为首个上市的国产PD-1产品,特瑞普利单抗的国际化进程也走在最前列。特瑞普利单抗是首个向FDA提交上市申请的国产PD-1,并且在鼻咽癌适应症上获FDA BTD认证。本届会议上,特瑞普利公布一线治疗复发/转移性鼻咽癌(r/m NPC)的国际多中心、双盲、安慰剂对照、III期临床注册研究(JUPITER-02)结果,并被ASCO收录为重磅研究摘要(LateBreaking Abstract,LBA)。JUPITER-02研究显示,与单纯化疗相比,特瑞普利单抗联合化疗组的PFS显著延长(HR =0.52),mPFS为11.7 vs 8.0个月。特瑞普利单抗联合化疗组和安慰剂联合化疗组1年PFS率分别为49%和28%。在包括PD-L1表达水平亚组在内的所有相关亚组中,均观察到特瑞普利单抗联合化疗组的PFS改善。截至2021年1月15日,OS尚未成熟。此外,特瑞普利单抗联合化疗组和安慰剂联合化疗组的客观缓解率(ORR)分别为77.4%vs 66.4%(P =0.033),中位缓解持续时间(DOR)为10.0 vs5.7个月(HR=0.50,95%CI:0.33-0.78)。看完上市药物进展之后,我们把目光转移到处于临床研究阶段的在研药物。1. First in class的口服CD11b调节剂GB1275尽管检查点免疫疗法已经彻底改变了癌症的治疗,但并非所有类型的肿瘤都获得了实质性益处。胰腺导管腺癌 (PDAC) 就是其中一种,作为高度致命的恶性肿瘤,对免疫疗法的反应非常有限。PDAC中广泛的免疫抑制性骨髓细胞浸润被认为是免疫治疗抵抗的主要机制。CD11b/CD18是一种在这些骨髓细胞亚群细胞表面上高度表达的整合素分子,并在炎症组织的转运和细胞功能中起重要作用。GB1275是First-in-class的口服CD11b调节剂,可减少髓源性抑制细胞 (MDSC) 和肿瘤相关巨噬细胞 (TAM),并将M2免疫抑制性TAM重新极化为M1表型,从而增加活化CD8+ T细胞的肿瘤浸润,并在临床前模型中显示了抗肿瘤功效。2020ASCO会议上,GB1275公布了一项单药和联合帕博利珠单抗的临床研究设计(KEYNOTE-A36)和早期的体内PK特性。这次,GB1275带来了早期的临床活性证据。截至2021年1月8日,45名受试者接受了治疗。在可评估受试者中,GB1275单药显示31.6%(6/19)的SD,联合用药中报告56.3%(9/16) SD。在联合用药组 (GB1275,800 mg),1例接受263天治疗的MSS-CRC(一种肿瘤微环境中浸润淋巴细胞水平较低,常导致免疫检查点抑制剂单药几乎无效的亚型)受试者报告了PR,1例胃癌(GC)患(因疾病进展先前接受帕博利珠单抗加巴土昔单抗治疗不到3个月)报告长期SD(227天);两例受试者都在继续接受治疗。GB1275单药和联合用药均观察到外周MDSC 的下调和肿瘤浸润淋巴细胞 (TIL) 计数增加。2. First-in-class的RAD51抑制剂CYT-0851同源重组 (HR) 是修复 DNA 双链断裂 (DSB) 必不可少的高保真性机制。RAD51蛋白对修复受损的DNA至关重要,RAD51蛋白在断裂处与DNA结合,并将其包裹在蛋白鞘中,完成修复过程中必不可少的第一步。在许多正常细胞的细胞核中,RAD51蛋白与其他许多蛋白相互作用,包括BRCA1/BRCA2,以修复受损的DNA。在数据截止日期 (DCO,2020年12月8日),23例晚期癌症患者(肉瘤:n=8;乳腺:n=4;非霍奇金淋巴瘤:n=5;胰腺:n=3;卵巢:n=2;粘液表皮样癌:n=1) 被纳入6个队列(15 mg、20 mg、30 mg和45 mgBID;90 mg和130 mg QD),尚未报告剂量限制性毒性。在DCO之前,10例患者的反应可评估的。两例接受45 mgBID治疗超126天和250天的DLBCL (-74%) 和粘液纤维肉瘤 (-30%) 患者根据Lugano和RECISTv1.1标准显示PR。另外,1例胰腺癌(-19%)和1例滤泡性淋巴瘤(-42%)在接受45mg BID治疗时获得SD,并且肿瘤缩小持续在111天和99天以上。CYT-0851是First-in-class的RAD51抑制剂,具有良好的耐受性。6例患者 (26.1%)经历了CYT-0851相关的不良事件,但只有1/2级恶心 (n=3,13%)和便秘 (n=2,8.7%)的患者数量在1例以上。CYT-0851是第一种在血液系统恶性肿瘤和实体瘤中均具有临床活性的DNA 损伤修复 (DDR) 治疗剂。3. First-in-class人源化IgG4单体COM701COM701是一种新型的First-in-class人源化IgG4单克隆抗体,可与含有脊髓灰质炎病毒受体相关免疫球蛋白结构域 (PVRIG)高亲和力结合,阻断其与其配体 PVRL2 的相互作用。阻断 PVRIG可增强T/NK细胞的活化,并在小鼠模型中抑制肿瘤生长。COM701虽然多次登录ASCO,但更多是临床实验设计和动态预告。本次,COM701带来了针对晚期实体恶性肿瘤的早期临床数据。在招募的51名DLT可评估患者中:A组(COM701 单剂量递增)8个队列纳入16例患者(0.01-20mg/kg,IV Q3/4 wks);B组(COM7010.3-20 mg/kg + nivolumab (NIVO) 360 mg/480 mg;IV Q3/Q4wks)5个队列共纳入15例患者。A组或B组均未报告DLT。抗肿瘤活性方面,A组(队列8),1例铂耐药的原发性腹膜癌患者已确认PR并持续14个月。B组(COM70110 mg/kg + NIVO 480 mg,IV Q4 wks),1例先前最后接受NIVO治疗的肛门鳞状细胞癌(SCCA)确认CR,并持续 18 个月。此外,多例不同瘤种患者获得SD。随着ADC技术的进展,ADC药物也在不断突破,甚至颠覆先前的治疗概念。RC48作为Her2靶向ADC,在Her2阳性瘤种中不断拓展,甚至向Her低表达进阶。RC48在本届会议上,同样有多项进展汇报,包括一项针对HER2阳性和HER2低表达的晚期或转移性乳腺癌的汇总分析。我们不妨从中窥探,RC48在靶标不同表达水平下的治疗差异。该分析涉及C001 CANCER (NCT02881138) 和C003CANCER (NCT03052634) 两项研究。数据截止日(2020年12月31日),共有118例女性乳腺癌患者入组并接受了RC48-ADC治疗。70例患者 (59.3%) 为HER2阳性,48例(40.7%)为HER2低表达。在HER2低表达亚组中,ORR和mPFS分别为39.6%和5.7个月。IHC 2+/FISH-(HER2阳性)患者的ORR和mPFS分别为42.9%(15/35)和5.7个月。对于IHC 1+患者(Her2低表达),即使COVID-19大流行导致一些治疗推迟,ORR也达到30.8%(4/13)。可以看出,RC48-ADC在HER2阳性和HER2低表达亚组分析中,相同治疗剂量下(2.0mg/kg)的ORR(42.9% vs39.6%)和mPFS(5.7 vs 5.7 m)显示出相对一致的疗效潜力。5. PD-L1/CTLA-4双抗KN046一线治疗NSCLCKN046是一种新型PD-L1/CTLA-4双特异性抗体,可阻断PD-L1与PD-1/CD80、CTLA-4与CD80/CD86的相互作用。ASCO会议上,继续报告针对初治IV期 NSCLC 患者的疗效和安全性,符合条件的患者可接受KN046联合含铂化疗。截至2021年1月19日,87例患者入组,其中83例患者具有肿瘤PD-L1表达数据(PD-L1 ≥1%:55.4%;PD-L1<1%:44.6%)。33.3%的患者继续接受研究治疗,66.7%的患者因疾病进展 (27.6%)、TEAE(13.8%)、死亡 (9.2%) 和其他原因 (16%) 停止治疗。在81例可评估疗效的患者中,ORR为50.6%,DCR为87.7%, mPFS为5.9 , mOS未达到,12个月和15个月的OS率为74.9%。非鳞NSCLC患者(n=8)ORR 和DCR分别为45.8%和89.6%,鳞状非小细胞肺癌患者(n=33)ORR和DCR分别为57.6%和84.8%。在PD-L1≥1%的患者中,mPFS为6.7个月(PD-L1≥1%的鳞状非小细胞肺癌患者为10.8个月)。
与之相对应,纳武利尤单抗联合伊匹木单抗(PD-1+CTLA4)治疗PD-L1≥1%的IV期或复发NSCLC研究(CheckMate227)中,mOS为 17.1 个月;阿替利珠单抗(PD-L1)单药治疗IV非鳞或鳞状NSCLC的研究(IMpower110)中,mOS达到20.2个月。多数双特异性抗体在拥有了先进治疗机制之后,能否在临床中显示超越单抗或联合治疗的临床获益,仍需持续关注。
本文来源于医药魔方;智通财经编辑:文文。