创新药行业的狂欢与落寞,可以说“成也License-in,败也License-in”。
License-in模式简单来说是利用海外医药研发的竞争优势,将在研产品授权引进国内,不仅能够让国外新药在国内同步上市,也能分享其中丰厚的利润。然而,随着连续两家License-in创新药企科创板上会被否,市场对很多License-in创新药企自身研发能力的质疑声越来越多,“创新搬运工”、“资本造富捷径”等词汇屡见不鲜。
作为一家典型的License-in模式企业,歌礼制药-B(01672)的困境就如同整个创新药行业的缩影。2018年顶着“港股首家18A公司”的光环上市后,公司股价就一路下行,截至2022年11月1日收盘价为2.6港元,已经较发行价14港元跌去超八成。11月2日,股价自底部反弹23%,截至发稿,最新股价为3.21港元。
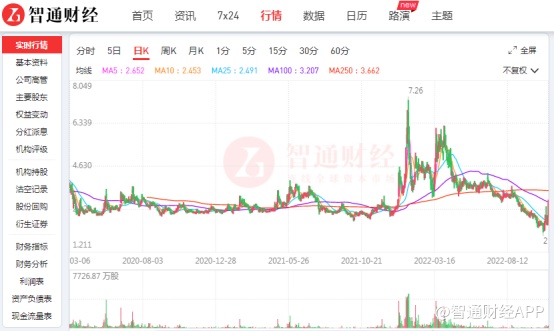
不被市场看好的原因,或许在于其自研能力稍显薄弱、营收主要靠合作推广海外药物的缘故。而在整个行业强调“真”创新的当下,歌礼制药未来还有多少发展空间?
自我造血能力薄弱 营收依赖一根“独苗”
赴港上市数年,歌礼制药仍然深陷亏损泥淖。
2018-2021年年间,公司归属母公司净亏损分别为人民币725.8万元、9596.9万元、2.09亿元和1.99亿元,在2022年上半年又继续亏损了8799.8万元,截止目前累计亏损了将近6亿元。
与此同时,公司营业收入并无明显增长。2022年上半年,公司取得总收入3821.8万元,同比增加4.6%。
若是细究收入结构,就会发现,上半年推广服务的收入占比超八成,且几乎全部来自派罗欣的销售。

派罗欣是一种适用于治疗成人慢性乙型肝炎的聚乙二醇干扰素α2a注射液。2018年11月,罗氏制药与歌礼制药签订了独家合作协议,歌礼获得派罗欣在中国大陆地区的独家市场推广权利,并有权获得一定比例的销售收入作为对价。
受益于中国庞大的乙肝患者群体,派罗欣一度成为罗氏在华销售的明星产品。但据智通财经APP了解,随着近年来如派格宾等国产长效干扰素、新型直接作用抗病毒药物(DAA)不断涌现,且丙肝、乙肝新的规范化治疗方案普及,派罗欣的市场需求正逐年下滑。
2022年9月,歌礼制药公告称,和罗氏所签订的派罗欣推广协议将于年底正式终止。对此,歌礼制药方面称,这主要是基于罗氏制药对派罗欣在中国大陆地区市场策略的调整,双方合作终止后,罗氏制药不会再寻求其他合作方,也不会在中国大陆地区开展派罗欣的商业推广。
从罗氏的产品布局来看,目前公司的营收主要来自于肿瘤学、免疫和神经疾病领域,而一个销量正在走下坡路的派罗欣已然可有可无。但对歌礼制药来说,陡然失去核心产品、营收支柱,短期内业绩显而易见将大幅缩水。在自研产品成功商业化之前,期间产生的营收缺口和资金压力如何填补?
核心产品商业化失利 自研进展缓慢
从研发费用的持续攀升也可以看出,近年来,歌礼制药在自研产品上颇下了一番功夫。2021年全年,研发开支为2.1亿元,较上年同期增长96%,占当期收入比为46.79%;2022年上半年,公司研发开支约为1.188亿元,较去年同期上升60.5%。
据智通财经APP了解,在产品管线布局上,公司已然涵盖了肿瘤、非酒精性脂肪性肝炎、病毒性疾病等多个领域。除了派罗欣之外,目前公司还有三种商业化产品,即戈诺卫® (达诺瑞韦)、新力莱® (拉维达韦)及利托那韦。
达诺瑞韦和拉维达韦是两款丙肝新药,原本被公司寄予厚望,但阴差阳错之下,并未取得预期中的成果。其中,直接抗病毒药物达诺瑞韦是歌礼制药引进的首款产品,由于其需要联合干扰素,在临床治疗的便捷程度和副作用都不如海外巨头的口服抗病毒药物。随着国内新药审评改革加速、海外竞品进入中国市场,加上达诺瑞韦接连数次错失医保谈判,最终失去商业先机。
拉维达韦则是全口服、不含干扰素的乙肝药物,尽管比起前辈达诺瑞韦更安全,但在2020年上市已然太晚,市场上激烈的竞争已使得同类药物普遍处于低价。
如今,公司手上的商业化产品只剩下利托那韦了,好在这款药物比前两款更加争气。利托那韦本身是一种已在临床使用的HIV-1蛋白酶抑制剂,也是新冠口服药物Paxlovid的组成之一,潜在市场相当广阔。
2022年2月,国家药监局批准Paxlovid进口注册,3月该药作为新型的特异性抗新冠病毒药物被首次写入新冠诊疗方案;10月,歌礼制药与辉瑞签订了利托那韦片的授权和采购协议,协议有效期为5年,歌礼制药将为辉瑞生产和供应利托那韦。
这份来得十分及时的协议,表明了在接下来的数年中,利托那韦将取代派罗欣,成为公司新的业绩支柱。
而在其他在研产品中,在肝炎和肿瘤领域,治疗非酒精性脂肪性肝炎的ASC40进展最快。今年1月,ASC40联合贝伐珠单抗治疗复发性胶质母细胞瘤的III期临床试验已经完成首例患者给药,进入关键临床的阶段。
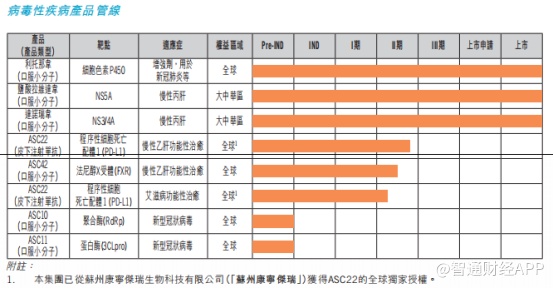
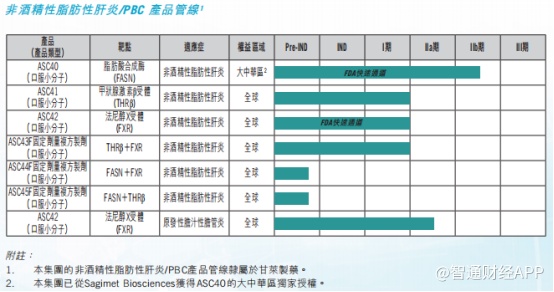
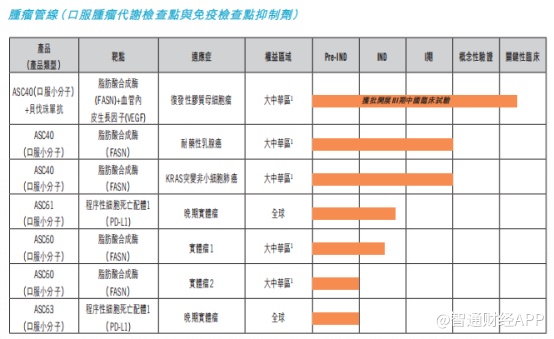
在非酒精性脂肪性肝炎(NASH)领域,口服小分子药物ASC41已进入II期临床试验;在新冠药物方面,ASC10临床试验申请已获得国家药监局批准,ASC11则已向FDA递交临床试验申请,预计2022年底前完成在健康受试者中的I期临床试验。
另一方面,鉴于公司目前的销售团队仅有70人,未来还需大量的商业化投入,公司的财务水平也需要纳入考量。截至2022年中报报告期,公司现金及现金等价物的期末余额为11.03亿元。
最新的人事变动反映了歌礼制药在商业化上做出的努力。6月,曾经担任日本原研药集团第一三共(Daiichi Sankyo)北美总裁兼首席执行官的John P. Gargiulo加入了公司的管理团队,出任首席商务官。
吃疫情红利 利托那韦能否成为“救命稻草”?
作为公司接下来主要的营收来源,利托那韦究竟有多少销售前景?这可以从市场供需和技术壁垒两方面来分析。
2021年11月,默沙东与辉瑞就像在比拼研发速度,在两天时间内相继宣布了自家新冠口服药的进展。虽然默沙东的Molnupiravir抢先一步,得了个“全球首款抗新冠口服药”的名头,但辉瑞的Paxlovid却是美国首个获批的口服抗新冠病毒药物,在速度上平分秋色。
新冠口服药的诞生意义重大:它无需注射、获取及服用更方便,成本也更低,利于向公众推广。有了新冠口服药再加上疫苗形成的防护网络,将大大降低新冠疫情对全球人民经济生活的影响。
从上半年的销售状况来看,辉瑞的Paxlovid实现销售额95.85亿美元,成为全球最畅销的新冠治疗药物。数据显示,美国本土从6月初至8月末,Paxlovid的销量从约44万个疗程增长到约61万个疗程,增速高达38%,在美国市占率超90%。在旺盛的需求下,辉瑞预计Paxlovid今年全年的销售额可达到220亿美元。
默沙东的Molnupiravir则相形见绌,上半年销售总计44.24亿美元。这主要是因为两款药物的靶点不同,且Molnupiravir属于核苷类药物,毒副作用较高。默沙东表示,对Molnupiravir今年的预期销售额为50-55亿美元。
在全球市场上取得开门红后,Paxlovid也并非就能高枕无忧。无论是日本制药巨头盐野义的S-217622,还是国产新冠口服药阿兹夫定片,都是潜在的竞争对手。
此外,Paxlovid本身也因为售价高昂、无法事先预防新冠、部分试验结果显示有患者“复阳”等负面因素而招致了一些担忧。
据智通财经APP了解,利托那韦最早由雅培(Abbott)的子公司雅培生命(后拆分为新公司艾伯维)所研发,该药的专利已于2017年到期,目前有不少公司仿制,但在中国企业中只有歌礼的利托那韦通过了生物等效性研究且获得了中国上市许可。
由于处方和工艺上可能存在差别,仿制药与原研药不一定能取得同等的药效。歌礼制药董事长吴劲梓曾在采访中透露:“利托那韦口服片的生物等效性研究非常难做,门槛很高,需要耗费四年左右的时间才能完成……纵观全球药企中,目前可以生产利托那韦且通过生物等效性研究的并不多,除了公司外,印度也有一两家,且也通过了生物等效研究,另外,美国也有一两家企业,但产能并不多。”
可以看出,歌礼制药押注在利托那韦上,打的就是一个仿制药的时间差:借助这个竞品较少的空档期,分享Paxlovid上市初期丰厚的利润。据披露,公司已进一步扩大利托那韦口服片年产能至约5.3亿片,并已向12个欧洲国家及中国香港递交了利托那韦的上市许可申请。
可以看出,受益于新冠口服药的繁荣,公司业绩在短期内仍有营收支撑。而从更长远的眼光来看,公司自研产品进展不及预期,和其他创新药企相比,稍显后继乏力。如果能够抓住这个关键的发展窗口期,后续未尝没有逆风向上的希望。