导览
美国时间2月8日FDA在官网上先公布了其将在10日ODAC会议上讨论的材料(FDA Briefing Document),材料详细阐述了FDA对信达生物和礼来此次PD-1单抗新药上市申请(BLA)的主要问题和观点,信达和礼来的回答材料预计在ODAC前也会陆续公布。这将是中国药企第一次以此种形式与监管机构进行公开对话,意义重大。药时代持续关注此次业内广泛关注的事件,就目前FDA挂网材料进行解读并与读者分享。值得一提的是,FDA公布的材料中,未对信迪利单抗的安全性和有效性提出质疑。
关注药时代之前的连续报道就可以看出,此次FDA在会议前大量的舆论引导是历史罕见的。在之前的留言中,读者朋友们早就为信达和礼来捏了一把汗,此行定是充满挑战。此次,FDA的ODAC会议材料只有32页,比常规的ODAC会议FDA的材料要少很多。所以不免令人猜想,这次ODAC会议本身,似乎与以往对科学问题的讨论方向不同。
一、果不其然,FDA出了六道“难题”
1.ORIENT-11不是一个国际多中心临床研究,与ICH E17指导原则描述不相符。
2.ORIENT-11不适用于美国人群和美国医疗实践。FDA列举了4点挑战
1)ORIENT-11对照组不适用于美国的标准治疗;
2)研究的临床终点是PFS不是OS,不适用;
3)研究人群与美国人群存在已知和未知的内源性和外源性因素差异;
4)研究不代表美国人种多样性。
3.如果研究不在美国进行临床研究注册申请,必须要符合GCP:ORIENT-11 缺乏与FDA的咨询和监督。
4.根据GCP要求,知情同意书没有及时更新标准治疗选择。
5.临床现场核查存在局限性,ORIENT-11研究者缺少参与国际多中心经验。
6.ORIENT-11 的适应症不是医疗迫切需求,不被授权监管灵活性。
二、信号明确,ODAC成为阐述规则的平台
如大家所知ORIENT-11是一项中国临床研究,信达和礼来的信迪利单抗是首个用单一中国临床研究数据在美国申报大适应症的PD-1单抗。这上面的每道题感觉都是围绕单一中国数据这个“致命点”来质疑信达与礼来,FDA同时提供了一些自己的分析和依据。FDA似乎已经给信达与礼来BLA的结果提前定下了基调,为什么还要大费周折地安排这次ODAC呢?
我们注意到FDA在材料中提到除了信达,还有超过25家企业正在或准备也使用单一或中国数据为主的方式进行申报。所以正如《CANCER LETTERS》报道所言,此次ODAC的目的不仅仅是讨论信迪利单抗的BLA,而是要给以单一中国数据的申报方式做一次明确的规则阐述。
回想2019年FDA肿瘤卓越中心主任Richard Pazdur博士在AACR上明确表示FDA 会“接受仅有中国患者的数据”批准药物,挑起了中国创新药企的高涨热情。但过去几个月Pazdur博士的公开表态突然有180度大转变,不断强调FDA更认可国际多中心临床试验(MRCT),单纯中国人种或亚洲人种的数据不能证明对于美国人种的适用性。
在BioCentury的采访里,Pazdur博士将此解释为“由于新冠病毒,以及临床试验的种族和种族多样化的需求,以及国会要求在临床试验中有更好的代表性,世界已经发生了巨大的变化”。背后缘由未有文章详细论述,只有寥寥数语,只能自行体会了。
三、标准不一,相同情况下的不同评判
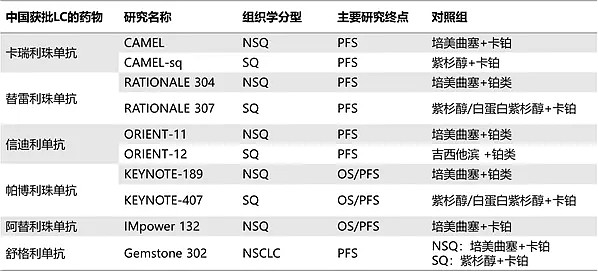
总览全文可以发现,FDA的这几个核心问题主要围绕三个方面,一是ORIENT-11不是MRCT,二是临床设计对照是化疗不是已获批的PD-1单抗,三是临床终点是PFS不是OS。
众所周知,ORIENT-11是一项在中国开展的临床试验,早在2018年8月就开始。当时进口PD-1单抗在中国的该项适应症还未获批,并且FDA在材料中列举的其他几个美国获批的PD-1/PD-L1单抗的对照组也是同样的化疗,并且都没做过头对头的临床试验。
关于临床终点的设计,根据CDE晚期非小细胞肺癌临床试验终点技术指导原则,随着治疗手段的丰富,OS不断延长增加了评价难度,因此,单独PFS或PFS与OS共同终点可被接受作为初治晚期NSCLC注册研究的主要终点,并且中国现在所有已批的PD-1单抗一线肺癌的终点都是PFS。
四、短短32页,四次质疑中国研究者缺乏MRCT经验
在关于GCP核查的介绍中,FDA多次质疑中国研究者缺乏MRCT经验,并且表示FDA检查的范围有限,所以不能确定是否有问题。FDA不能直接表态是否合格,只表达了其核查做得还不够。对于此次GCP核查的具体内容,只能在10日具体会议内容公布后才能了解清楚。
近年来,中国监管部门大刀阔斧的改革、中国创新药的发展、临床试验观念的普及以及中国医生一如既往高水平的科研能力和丰富的临床实践经验,使得中国临床试验行业得到了极大的规范和发展。有报道显示,十三五期间,中国临床试验机构能力稳步提高,全国备案临床试验机构总数达1012家。肿瘤药物研发蓬勃发展,肿瘤注册药物试验数量持续增长,从2016年的222项增加到2020年的722项,增幅达225%。同时参与临床试验的中国PI(主要研究者)复合增长率为10%,说明中国的临床专家正在主导临床研究,而不是简单的参与和贡献入组病例。近年来,中国研究者在AACR,ASCO,ESMO,ASH等顶级学术会议上口头报告和壁报数量也大幅增加。ODAC会议一直被认为是一场科学讨论会议,如果前几个问题还与科学多少有一点关联,但是这一条对于中国临床试验和中国医生的武断质疑,则与科学探讨本身关联不大,并显然缺乏调研及判断依据。




五、任重道远,共同摸索出海规则
FDA的态度从甜蜜暧昧到反向收紧,以及在ODAC之前如此反常的密集公开造势,使得我们在看到这份公开的“试卷”之时,已不难理解FDA的出题思路。此次ODAC不仅是信达和礼来的PD-1单抗去参加考试,更是代表了一批中国创新药企去接受FDA的考验。
中国创新药行业相对于美国还处在起步阶段,在迈向全球化的道路上,我们首先得学习、理解、遵循FDA制定的监管规则。但同时,我们应该有勇气有底气去与全球最高监管机构进行平等对话,证明中国的创新药是值得信赖的高质量产品,完全可以造福包括美国患者在内的全世界患者。不管最后“考试”结果如何,我们都期待2天后信达能够全力以赴,积极应对这次大考,让全球看到中国创新药企的风貌和表现。我们也期待这次事件能够为中国新药出海,趟出一条路,探明方向。
本文来源于雪球;作者:药时代;智通财经编辑:谢雨霞。





