近期,全国多地再现新冠疫情。目前公开的病毒基因测序结果显示,此次疫情的“幕后黑手”正是B.1.617.2(Delta)变异株。
最早在印度发现的Delta毒株可谓来势汹汹,正在成为全球流行的主要新冠病毒变异株。与2020年11月在英国发现的B.1.1.7(Alpha)变异株相比,Delta变种潜伏时间更短,传播速度更快。据世界卫生组织统计,目前Delta毒株已传播至全球逾80个国家或地区。
2021年7月12日,广东省疾控中心上传到medRxiv的研究显示,Delta毒株确诊病例的病毒载量是感染原始毒株患者的1260倍。此外,原始毒株在人体内可被检测出来的时间为6天,而Delta毒株仅暴露4天后就能被测出。这说明Delta变种的复制能力更强。
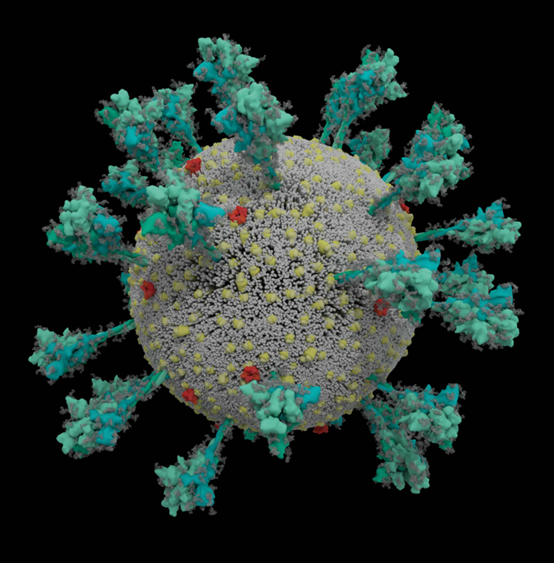
计算机模拟的新冠病毒SARS-CoV-2结构(来源:Nature)
新冠病毒SARS-CoV-2是怎样入侵人体的?Delta毒株为何如此凶险?7月28日最新发表在Nature杂志上的一篇文章带给我们很多启发。

来源:Nature
有数十年对冠状病毒的研究作为基础,科学家们通过19个月的努力,详细描述了新冠病毒入侵人体的过程,期望能从病毒的生命周期中找到破解病毒传播的方法。
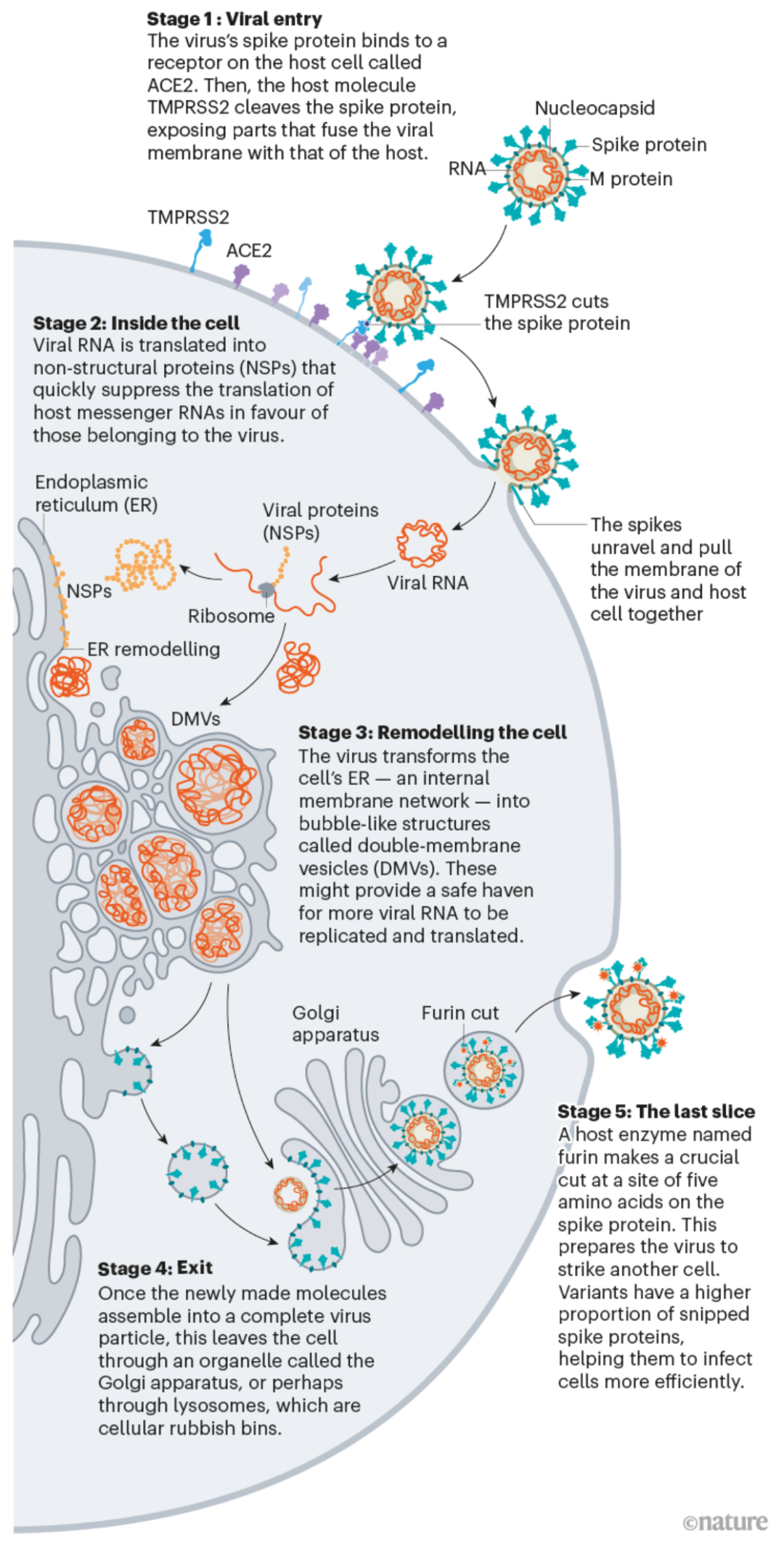
新冠病毒的生命周期(来源:Nature)
从S蛋白说起
冠状病毒SARS-CoV-2表面布满凸起的S蛋白(Spike Protein)。S蛋白属于第一类病毒膜融合蛋白,是病毒依附并入侵人体细胞的关键。S蛋白表面包裹着聚糖,可以掩护病毒躲过人体免疫系统的侦查。
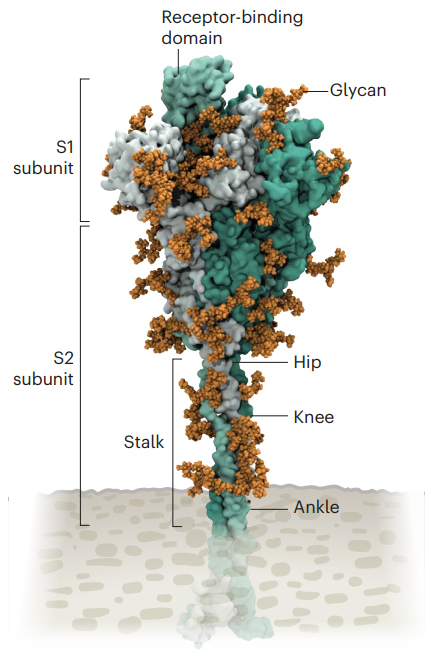
S蛋白的结构(来源:Nature)
从S蛋白开始,SARS-CoV-2就表现出比其他冠状病毒技高一筹。拿流感病毒来说,其外部的融合蛋白相对刚性。而SARS-CoV-2的S蛋白非常灵活,可以与三个点铰接,这就使它更易于吸附在人体细胞上。
S蛋白大体上分为3个部分,顶部的受体结合域(RBD)、S1亚基和S2亚基。S1亚基与RBD相连,负责与细胞膜上的受体结合;S2亚基主要促使病毒与细胞膜的融合。
新冠病毒的变异主要出现在S蛋白中。序列出现突变时,会导致RBD更有可能出现在顶端的位置,病毒就更容易进入细胞。Delta变种的S1亚基比Alpha变种出现了更多的突变,仅在RBD中就发生3处突变。使S蛋白与细胞膜上受体的结合能力提高,逃避免疫系统的能力也有所增强。
细胞膜上的两个“叛徒”
SARS-CoV-2又是如何入侵细胞的呢?
这就不得不提到细胞表面的一个关键受体——血管紧张素转化酶2(ACE2)。病毒想要入侵人体细胞,必须借助S蛋白抓住细胞膜表面的ACE2蛋白,并与之结合,才能进入人体细胞“为非作歹”。 也就是说,如果把细胞比作一个房间,那么ACE2蛋白就像房间“门把手”。在SARS病毒中,ACE2蛋白也是病毒与细胞的对接点。而由于新冠病毒RBD的特殊性,它与ACE2结合的强度是 SARS病毒SARS-CoV的2-4倍。而Delta毒株的S1亚基发生了突变,导致S蛋白与ACE2结合的能力更强。 一旦S蛋白抓住了ACE2这个门把手,SARS-CoV-2就立即启动与细胞膜的融合过程,准备“破门而入”。
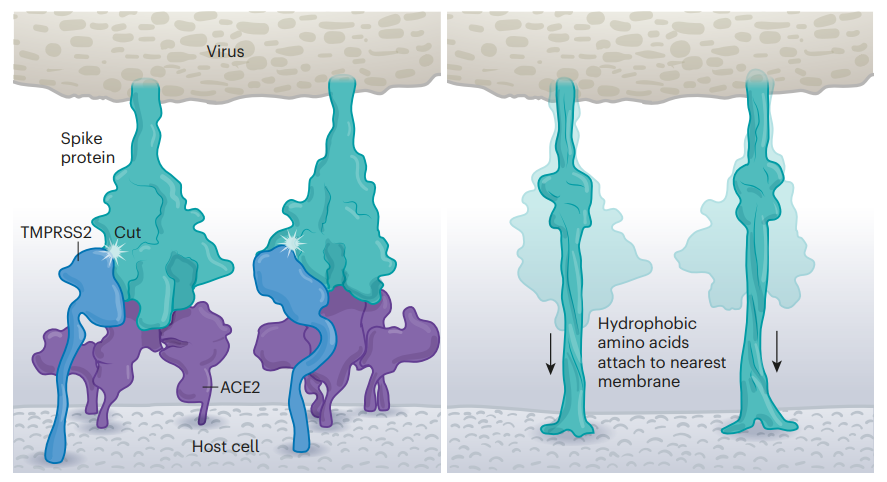
SARS-CoV-2与细胞膜的融合过程(来源:Nature)
入侵过程中不得不提到另一个关键分子——跨膜丝氨酸蛋白酶(TMPRSS2)。TMPRSS2可以在S蛋白的S2亚基上切出一个小口,暴露一系列疏水氨基酸。这些氨基酸迅速隐藏到最近的宿主细胞的细胞膜里。接着,S蛋白像拉链一样把自己折叠起来,迫使病毒和细胞膜融合。 如果把ACE2比作“门把手”,那TMPRSS2可谓是名副其实的“润滑油”。在TMPRSS2和ACE2这两个“叛徒”的帮助下,SARS-CoV-2就顺利入侵人体细胞了。与SARS病毒只能通过组织蛋白酶L利用内吞机制进入细胞相比,这种入侵方式可谓更高效。这也解释了为什么抗疟疾药物氯喹不能阻止SARS-CoV-2的入侵,对治疗新冠肺炎无效。
挟持细胞变成“病毒工厂”
入侵细胞后,SARS-CoV-2开始“为非作歹”。 病毒将自己的RNA注入人体细胞,迅速“攻城略地”。利用细胞质中的核糖体,制造合成自身RNA所用的蛋白质和结构蛋白(如S蛋白)等。接着,病毒开始大量复制自身的遗传物质。那怎样打压宿主mRNA的翻译,使细胞全力支持自己蛋白质的制造呢?SARS-CoV-2有它的高招。 首先,病毒从根源上减少了这种竞争。当病毒到达细胞时,最早翻译的一批蛋白质中有一种叫作Nsp1。这种蛋白非常有意思,它可以在宿主细胞内发号施令,召集细胞内的相关酶,把没有病毒标签的mRNA全部切碎。 其次,当细胞被病毒感染后,蛋白质的翻译量减少了70%。这次的“罪魁祸首”还是Nsp1,它会阻断mRNA进入核糖体的通道,余下的产能全部用于病毒自身蛋白的翻译。 再者,病毒关闭了细胞的报警系统。病毒阻止了人体细胞的mRNA从细胞核进入细胞质的过程,使原本可以提醒免疫系统注意的信号蛋白翻译受阻。 魏茨曼科学研究所的病毒学家表示,这三种机制都不是SARS-CoV-2所特有的。但SARS-CoV-2能同时利用三种机制,且速度之快,效率之高,在所有病毒中几乎是独一无二的。
改造“病毒工厂”
挟持细胞成为“病毒工厂”还不够,病毒刚站稳脚跟,就要对这个“工厂”内外来一个彻底的大改造。 先看细胞外部。病毒的S蛋白会移动到细胞表面,从细胞内破膜而出。此时细胞膜上的钙离子通道被打开,病毒将一种特殊涂层送到细胞外。这种涂层与人体自然融合到一起的细胞(如肌肉细胞)表面上的涂层是一致的。这样,被感染的细胞与邻近能表达ACE2的细胞发生融合,最终甚至能形成包含20多个细胞的合胞体。
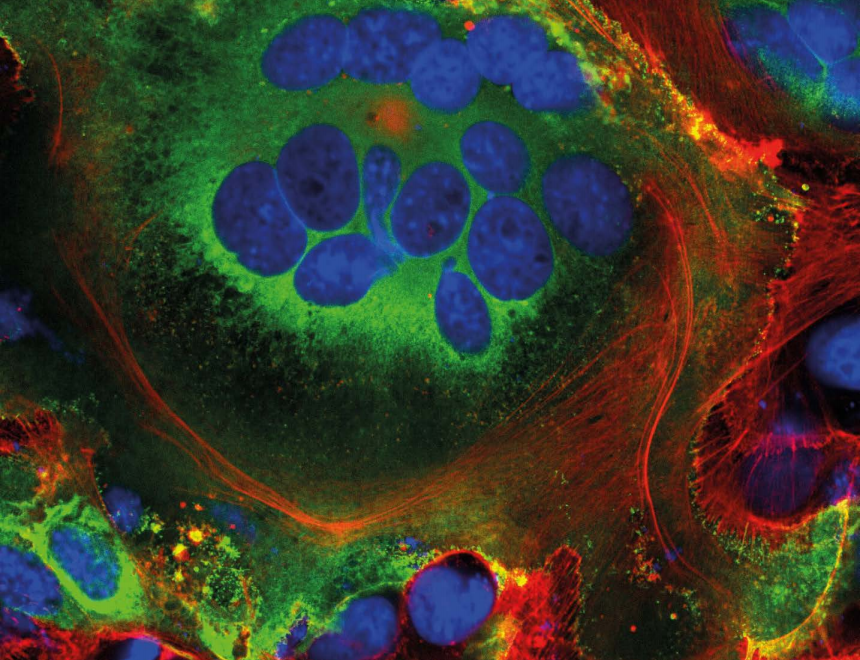
表达新冠病毒S蛋白(绿色)的细胞的融合细胞结构(合胞体),蓝色为细胞核,红色为细胞骨架(来源:Nature)
病毒的最终目的是不断增殖下去,这就需要人体细胞生存的时间尽量长,这也是为什么病毒要让这些“工厂”合并起来。中国医学科学院的科学家团队甚至发现,SARS-CoV-2感染的细胞甚至能与淋巴细胞发生融合来躲避免疫系统的侦查。要知道以前这项技能可是肿瘤细胞才有的。 与此同时,细胞内部结构也发生了巨大变化。内质网、高尔基体、溶酶体等一些细胞器都被病毒一一改造,使人体细胞更适宜它的增殖。还有许多SARS-CoV-2病毒的行为目前没有得到很好的解释,例如为何病毒选择从溶酶体离开细胞,而不是与大多数冠状病毒一致,从高尔基体离开。
再出发
离开细胞时,SARS-CoV-2也有高招让自己变得更容易传播。 其他冠状病毒中,S蛋白的S1亚基和S2亚基之间通常只有一个氨基酸相连。而SARS-CoV-2的S1和S2之间足足有5个氨基酸,这对病毒入侵肺部细胞至关重要。人体细胞中有一种叫作Furin的蛋白酶可以识别并剪切这段氨基酸,暴露出S蛋白上的开放结构域。
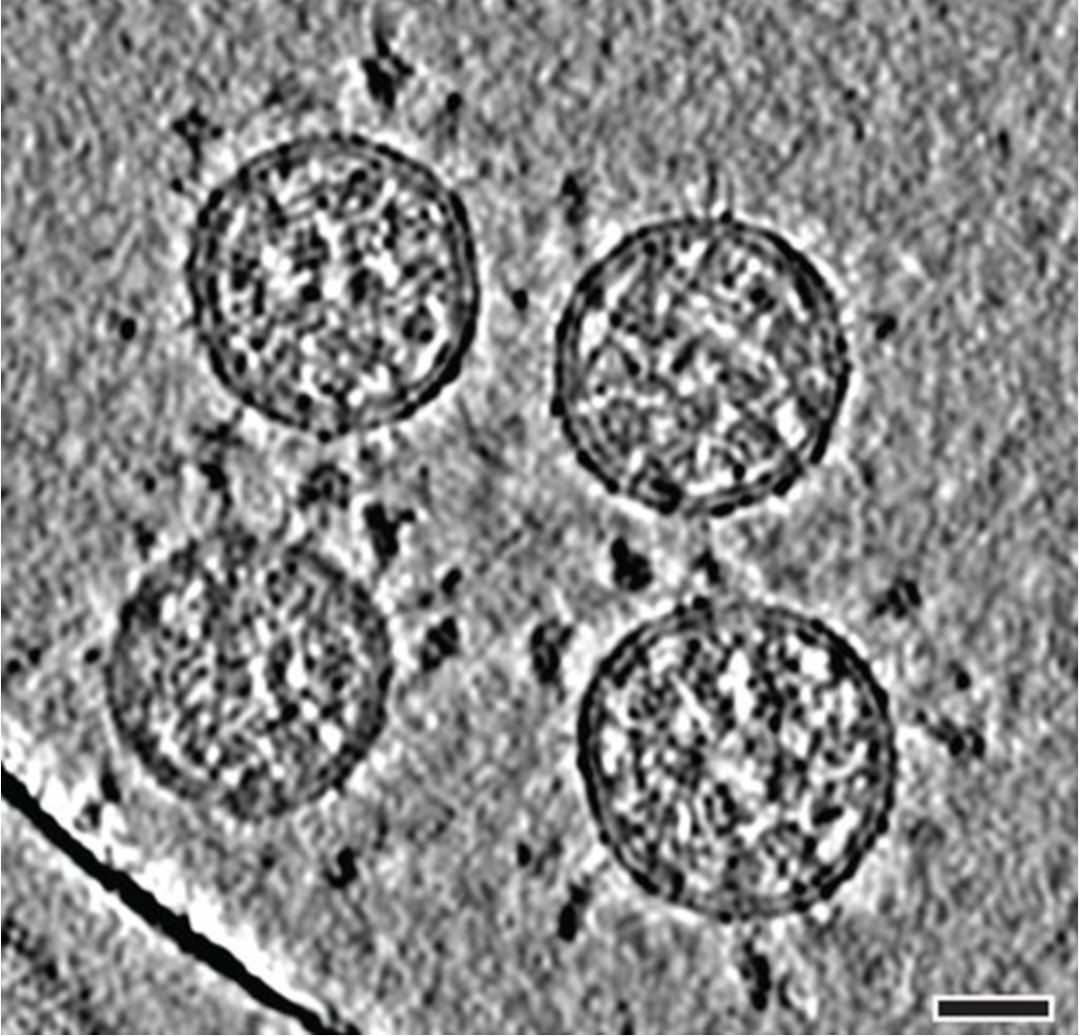
电镜下的SARS-CoV-2(来源:Nature)
还记得前面提到的病毒进入细胞的帮凶TMPRSS2吗?有了Furin的切割,TMPRSS2对S蛋白的二次切割才会更高效。这样一来,S蛋白与ACE2的结合能力更强,进攻人体细胞也更容易了。
科学家们发现,相比于其他冠状病毒,SARS-CoV-2经过Furin加工过的S蛋白比例有明显上升。SARS病毒中这一比例只有不到10%,新冠病毒的Alpha变种中上升为50%左右。而在高传染性的Delta变种中,这一比例高达75%。
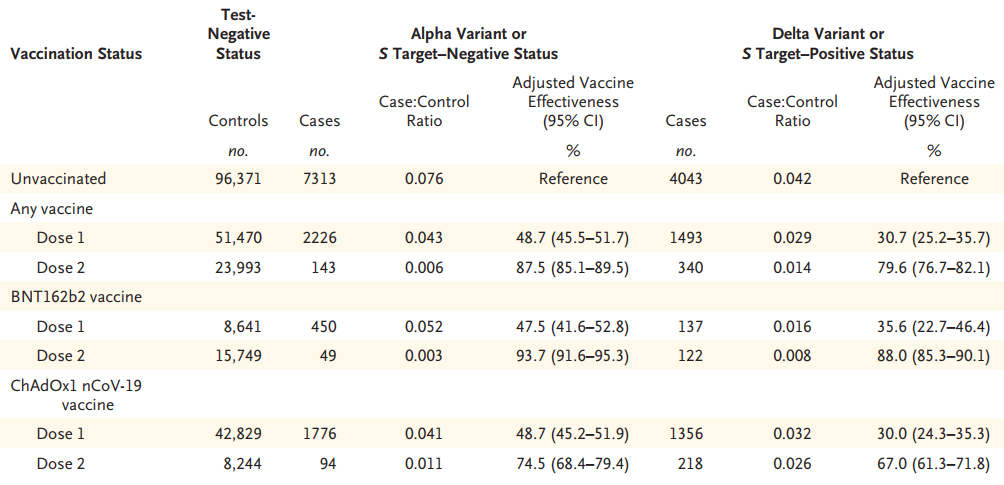
比起传播能力的增强,更让人忧心的是病毒变种是否会受影响疫苗的有效率。7月21日,由英国公共卫生部完成,刊登在顶级医学期刊NEJM的一项研究显示,研究调查的两种疫苗预防Delta变种感染的有效率稍有下降,但在两剂接种完成后,仍能提供较好的保护效果。
来源:New England Journal of Medicine
具体来说,研究结果显示,接种完两剂mRNA疫苗BNT162b2(开发商:辉瑞/BioNTech/复星医药)后,预防有症状Alpha变种病毒感染的有效率可达93.7%,针对Delta变种的有效率仍有88.0%。接种完两剂腺病毒载体疫苗ChAdOx1 nCoV-19(开发商:阿斯利康/牛津大学等)后,预防有症状Alpha变种病毒感染的有效率达到74.5%,针对Delta变种的有效率为67.0%。
小 结
面对SARS-CoV-2,我们仍有很多未知。期待在全球科学家的共同努力下,我们能够早日揭开SARS-CoV-2及其多种变体的真正“软肋”,找到打败COVID-19的制胜之道。
本文选编自“医药魔方Pro”,作者:海默;智通财经编辑:魏昊铭。