摘要
CAR-T细胞概念
CAR-T细胞是经过基因工程改造以表达靶向特定抗原的嵌合受体的T细胞。CAR-T细胞是经基因改造的T细胞,配备有嵌合抗原受体(CAR),它能使T细胞识别并消灭表达相应抗原的细胞。
全球上市CAR-T细胞疗法
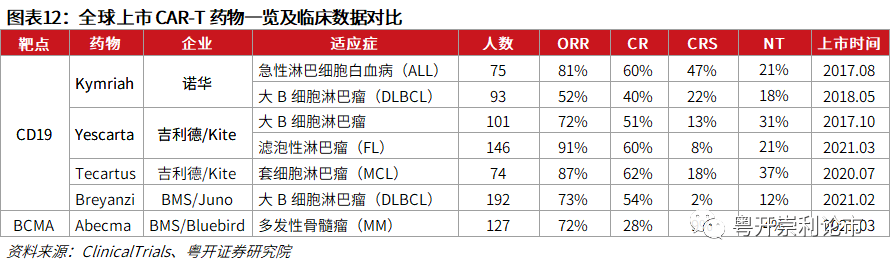
全球共5款CAR-T细胞疗法获批上市,包括四款靶向CD19和一款靶向BCMA的CAR-T细胞疗法。
Yescarta有望成为国内首个获批上市的CAR-T细胞疗法,复星医药(02196)旗下的复星凯特拥有其大中华区权益。
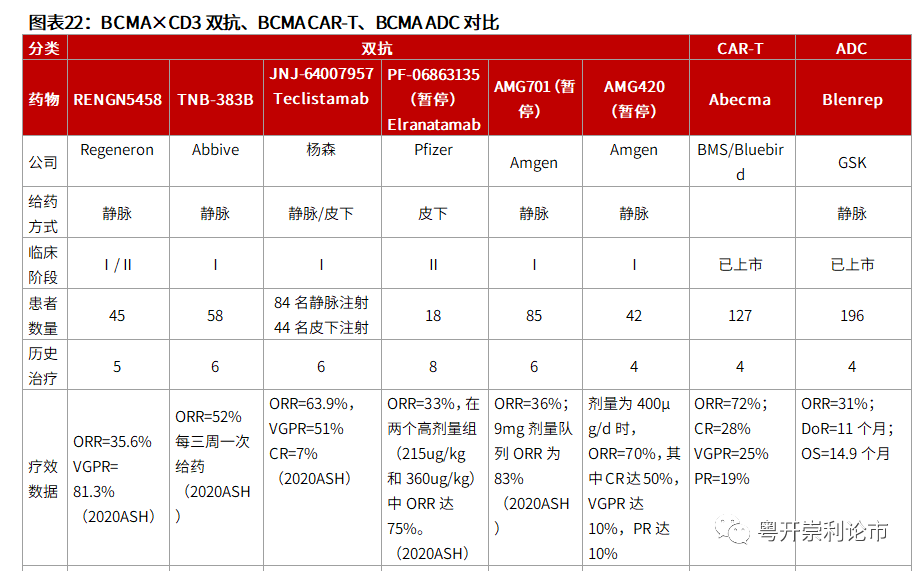
Abecma是全球首款获批上市BCMA CAR-T疗法,根据目前已披露的临床数据,ORR和CR率较创新双抗及ADC疗法存在显著优势。
国内CAR-T细胞疗法进展
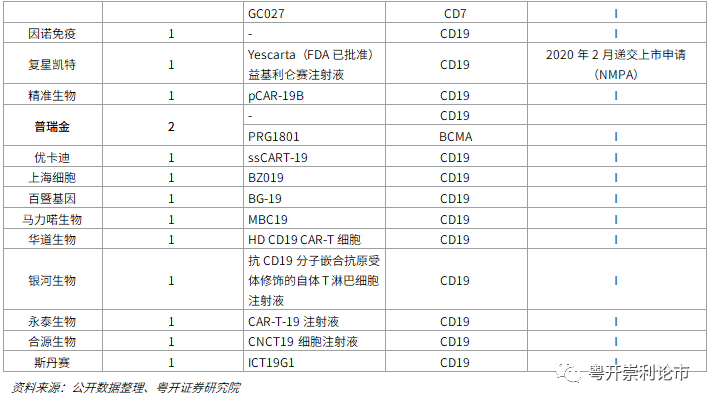
尽管国内目前尚无CAR-T产品获批上市,但CAR-T产品的研发热情极高,已有335个正在进行的CAR-T临床试验,其中临床居前的包括传奇生物、药名巨诺(02126)、复星凯特、科济生物等,涉及的靶点包括CD19、BCMA、CD4等血液肿瘤靶点及Claudin 18.2、GPC3、MSLN等实体瘤靶点。
传奇生物(LEGN.US):传奇生物拥有7款处于临床阶段的CAR-T细胞疗法。其中,JNJ-4528是传奇生物与强生(JNJ.US)联合开发的一款靶向BCMA的CAR-T产品,已于2020年12月向FDA递交了BLA申请,有望于2021年Q3-Q4上市。
复星凯特:复星凯特生物为复星医药与美国Kite Pharma(KITE.US)的合营企业。2020年2月,复星凯特向NMPA递交Yescarta的上市申请,用于治疗DLBCL。
科济药业(02171):科济药业是一家专注于研发治疗血液恶性肿瘤和实体瘤的创新CAR-T细胞疗法公司。公司目前拥有四款处于临床阶段的CAR-T产品,其中CT053为一款靶向BCMA的CAR-T产品,目前处于Ⅱ/Ⅲ期,有望成为安全性最高的BCMA CAR-T产品。
本文作为CAR-T深度报告系列的首篇,简要概述国内CAR-T产品的临床进展,国内企业CAR-T细胞疗法临床数据梳理及对比分析请关注《CAR-T深度报告(二):国内CAR-T细胞疗法梳理》。
风险提示
药物研发不及预期,商业化不及预期,研发同质化风险


一、CAR-T细胞疗法
(一)CAR-T的概念
CAR-T细胞是经过基因工程改造以表达靶向特定抗原的嵌合受体的T细胞。CAR-T细胞是经基因改造的T细胞,配备有嵌合抗原受体(CAR),它能使T细胞识别并消灭表达相应抗原的细胞。
简而言之,CAR-T即CAR与T细胞的组合。CAR全称Chimeric Antigen Receptor,即嵌合抗原受体,是与抗原识别结合域融合的T细胞受体(TCR)的嵌合分子。尽管CAR-T细胞具有天然的TCR,但主要通过CAR受体识别其他细胞表面的特定抗原。因此,与TCR介导的识别不同,CAR的抗原识别不依赖主要组织相容性复合物(MHC),因此可以减轻T细胞受体(TCR)诱导免疫的局限性。
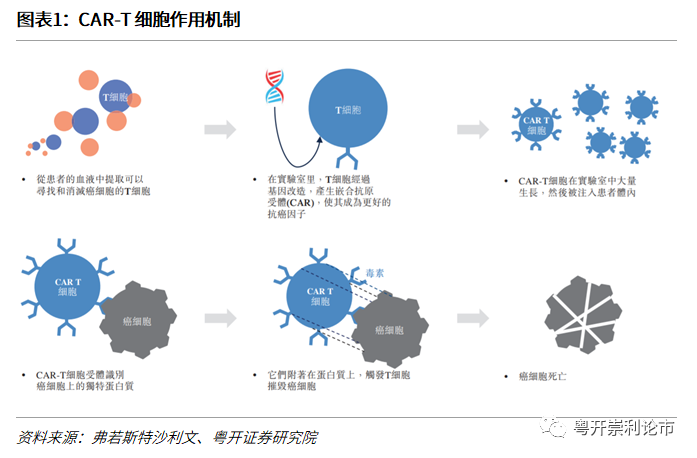
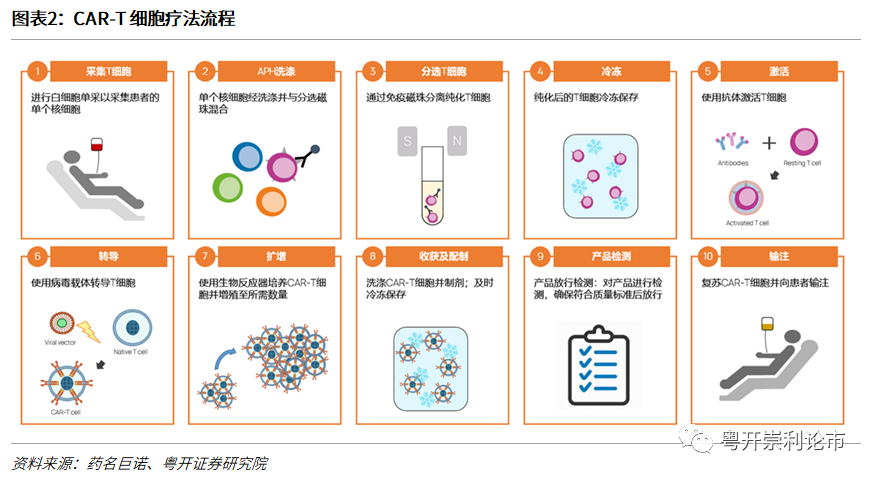
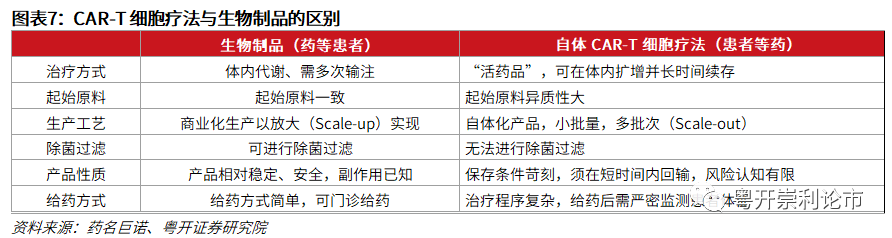
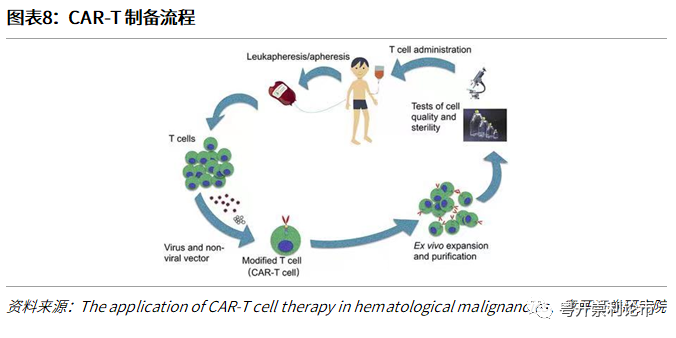
自体CART细胞的制备首先须从患者外周血中取出T细胞,通过离心去除粒细胞集落刺激因子(GCSF),有研究表明粒细胞集落刺激因子可能干扰T细胞的增殖和表达。其次通过带有对CAR结构编码质粒的病毒载体转染等方式,最后体外扩增、纯化,检测CAR-T细胞的质量并灌输至患者体内。此外,在制备CAR-T细胞的同时,患者须接受预处理化疗(即清淋),通常使用环磷酰胺或氟达拉滨等化疗药物减少机体对改造后的CAR-T细胞的排斥反应,以提高CAR-T细胞注入后的疗效。
(二)CARs的组成
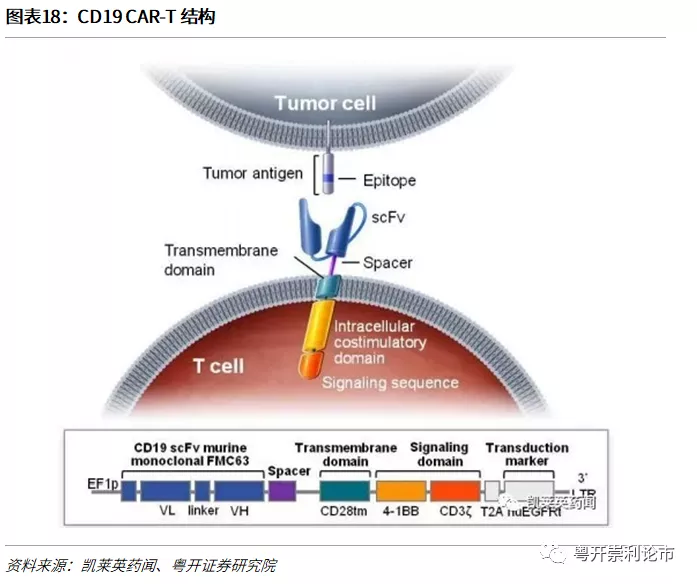
从结构上看,CARs主要由三部分功能区域组成,包括胞内结构域、跨膜结构域和胞外结构域。
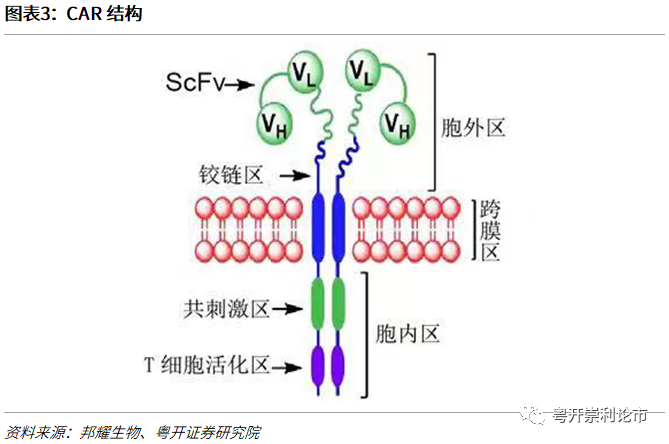
(1)胞内结构域由共刺激结构域(Costimulatory Domain)和信号转导结构域(Signaling Domain)组成。共刺激结构域主要包括CD28受体家族(CD28)或肿瘤坏死因子受体家族(4-1BB、OX40、CD27)。共刺激结构域的主要功能为协同刺激分子和活化细胞内信号,使T细胞持续增殖并释放细胞因子,提高T细胞的抗肿瘤能力。如4-1BB共刺激域可促进线粒体生成,增强T细胞的呼吸作用和脂肪酸氧化,抗原刺激后,CAR-T会优先分化为中央记忆T细胞。信号传导结构域通常为T细胞受体TCR/CD3ζ,可发挥T细胞信号转导功能。
(2)跨膜结构域将CAR的细胞外结构域和细胞内结构域连接,并将受体锚定于T细胞膜上,常用的跨膜结构域来源于CD4、CD8α、CD28和CD3ζ。
(3)胞外结构域主要由抗原识别结构域和铰链区构成。抗原识别结构域可识别肿瘤相关抗原(TAA),主要采用scFv。单链抗体scFv(Single Chain Variable Fragment)是由抗体重链可变区(VH)和轻链可变区(VL)通过10-25个氨基酸组成的柔性短肽(linker)连接而成,是较小的重组抗体形式(约27kDa),不但保留了原始免疫球蛋白对抗原的特异性,而且增强了肿瘤穿透力。但目前CAR-T细胞常用的scFv源于小鼠,可能增加排斥反应或抑制物抗宿主病的风险。铰链区连接scFv和跨膜结构域,研究表明,CAR-T细胞活化与铰链区长度有关,例如当抗原表位不可接近时,使用更长的铰链区可以使scFv克服空间位阻,有效结合抗原。
(三)CAR-T细胞的分类
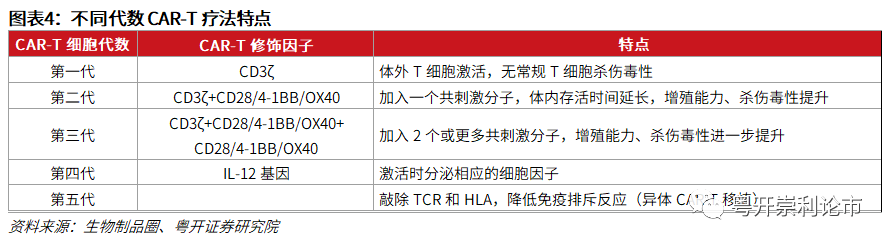
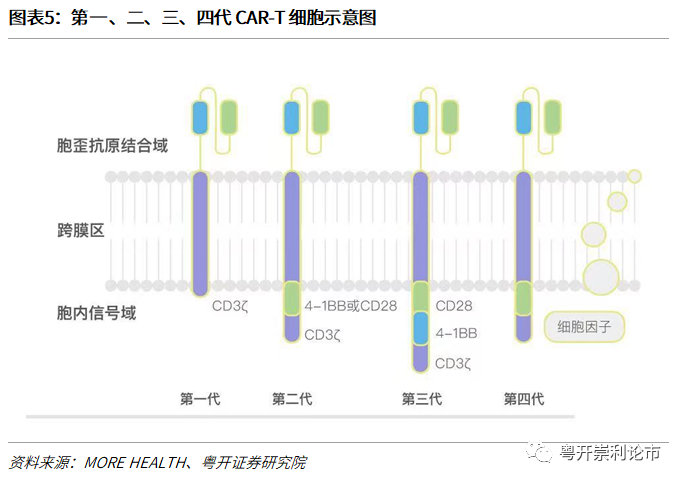
CARs根据其胞内共刺激结构域域可分为五代,但上市的CAR-T细胞疗法普遍为二代CAR-T:
第一代仅由胞外结构域、跨膜结构域和胞内信号转导结构域组成,但由于缺少共刺激信号的刺激,无杀伤功能或杀伤功能较弱,体内存活时间短;
第二代CAR-T具有1个独特的4-1BB或CD28或OX40分子共刺激结构域,增强了来自TCR-CD3复合物的“信号一”,T细胞增殖能力和杀伤毒性提升。但研究发现CD28作为共刺激分子时,T细胞杀伤作用强但持续时间短;而4-1BB作为共刺激分子时,持续时间长但杀伤能力有限。目前临床普遍使用第二代CAR-T细胞,并已显示出较好的临床疗效。
第三代CAR-T包含两个或更多个共刺激结构域的分子,有望进一步提升基因工程T淋巴细胞的活性和效力。但一些研究发现,第三代CAR-T细胞的临床表现并未优于第二代CAR-T细胞,甚至劣于第二代CAR-T细胞;
第四代CAR-T在第二代的基础上增加表达特定的细胞因子(IL-12、IL-2等),也称为“TRUCK”细胞,可在激活时分泌相应的细胞因子。IL-12是在局部肿瘤病变中吸引先天免疫细胞(巨噬细胞和NK细胞)的重要策略,第四代CAR-T细胞分泌IL-12可吸引NK细胞和巨噬细胞浸润到肿瘤部位,进一步增强CAR-T细胞的有效性。
第五代CAR-T细胞通过敲除内源性T细胞受体(TCR)和白细胞抗原Ⅰ类分子(HLA),既降低异体移植时的免疫排斥反应,也避免了异体T细胞对宿主器官的免疫攻击(GvHD)。
(四)CAR-T疗法的优劣势
癌症的常规治疗包括化疗(Chemotherapy)和靶向治疗(Targeted Therapy)。尽管化疗在临床运用中十分广泛,但由于其治疗非特异性的特点,对于肿瘤细胞和正常细胞存在相同的杀伤力,易引起多种副作用,长期来看,反而削弱了人体对癌细胞的天然防御能力。靶向治疗通过抑制肿瘤生长所需的特定分子靶点,可精准攻击并杀灭癌细胞,但由于癌细胞基因突变位点的变化,靶向治疗不可避免地存在耐药性。
近年来,CAR-T疗法的发展方兴未艾,已成为多种血液肿瘤的替代治疗方法,CAR-T最显著的优势在于:
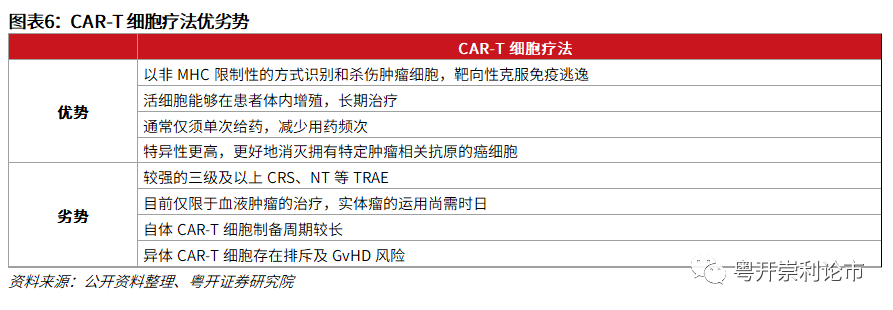
(1)CAR-T细胞能够以非MHC限制性的方式识别和杀伤肿瘤细胞,不需要抗原递呈,靶向性克服免疫逃逸,显著延长患者生存期;
(2)CAR-T疗法注入的活细胞能够在患者体内增殖,与化学药物和生物制剂相比,CAR-T细胞可以在患者体内维持长达数周或数月,减少了患者的用药频次,有望减少因剂量和给药频次导致的副作用,更好提升患者的治疗耐受性。
(3)CAR-T疗法可通过与专门设计的CAR结构融合,适应多种肿瘤相关靶点,更加精准地消灭拥有特定TAAs的癌细胞,避免杀死其他健康细胞。
(4)CAR-T疗法一般仅须单次给药,传统的化疗或单克隆抗体药物需要经过多个治疗周期(一般为六至八个周期)长达数月的治疗。
CAR-T疗法也存在诸多不足,包括:
(1)在CAR-T疗法中,由于T细胞在短期内大量被活化,细胞因子的释放短时间内呈爆发式增长,导致细胞因子释放综合征(CRS)、巨噬细胞活化综合征等严重不良反应。此外,神经毒性是CAR-T疗法的另一严重毒副作用,临床症状包括幻视、谵妄、言语障碍症等,临床上常使用托珠单抗(IL-6受体抑制剂)或糖皮质激素予以治疗。
(2)目前获批上市的CAR-T疗法局限于血液肿瘤的治疗,靶向B淋巴细胞上的特异性抗原(如CD19和BCMA)。CAR-T疗法尚未覆盖实体瘤的关键原因在于相关肿瘤靶点(TAAs)除了在肿瘤细胞表面表达外,在健康细胞表面同样表达,而靶向B淋巴细胞的CAR-T疗法一个常见的副作用是健康B细胞的清除,但由于CD19在大多数正常组织中不存在,仅在正常B细胞表面存在,即使被清除后患者也可以通过终生注射丙种球蛋白补充B细胞,因此安全性较高。
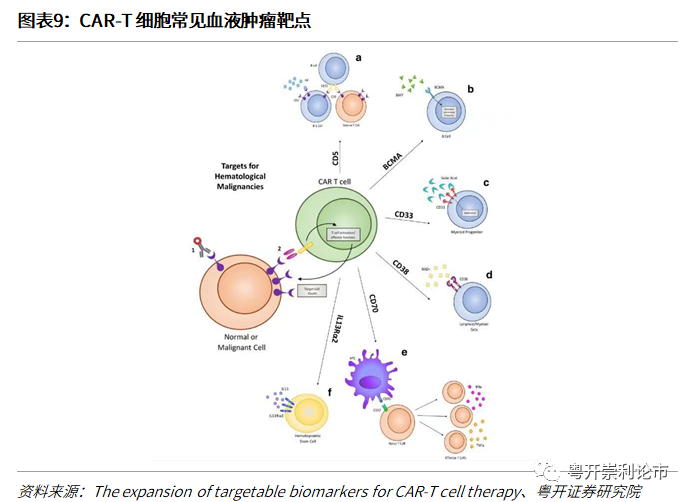
但对于实体瘤的治疗,一方面缺失适宜的补充疗法,另一方面难以找到在肿瘤细胞表面高表达,在健康细胞表面不表达的特异性靶标。但随着科学的发展,实体瘤适应症未来有望被攻克,目前超过14种实体瘤靶点正处于临床阶段,包括VEGF、PSMA、EpCAM等。CAR-T实体瘤靶点的设计思路一是寻找在肿瘤细胞高表达、在健康细胞低表达的靶标,如NY-ESO-1(肿瘤睾丸抗原)凭借在健康组织中局限表达,在癌症中高表达的特性有望为CAR-T用于实体瘤提供一种特异性强、而毒副作用弱的靶标抗原;二是增强CAR-T细胞的特异性,更精准地定位肿瘤靶点。
(3)自体CAR-T细胞的制备需要较长的生产时间,但异体CAR-T存在GvHD和排斥反应。自体CAR-T细胞的制备通常需要在良好GMP环境2-4周才能制备,且价格昂贵,治疗费用常高达几十万美元。此外,由于癌症患者体内淋巴细胞计数低,自体修饰T细胞的扩增和生产难度较大。尽管由健康供体制成的即用型异体CAR-T细胞未来发展前景广阔,但由于不相容性可能导致严重的移植物抗宿主病(GvHD)。另一方面,排斥反应可能导致异体CAR-T细胞的清除。目前,可采用HLA敲除或淋巴切除化疗(清淋)等办法减少排斥反应发生的风险。
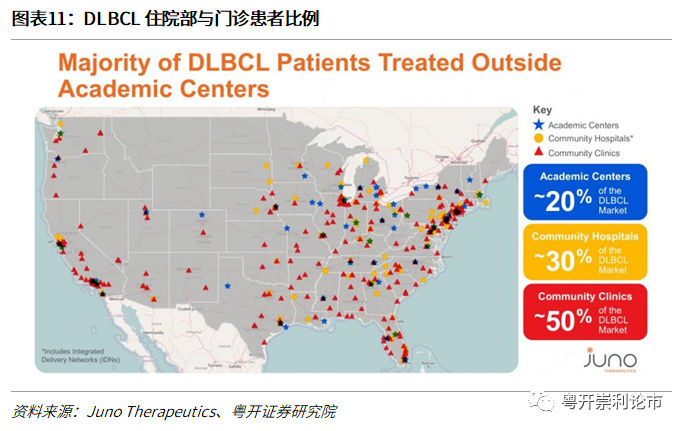
针对价格过于昂贵的问题,考虑到接近50%DLBCL患者多数在医院外接受治疗,Juno Therepeutics公司认为,未来病人在门诊接受CAR-T治疗有望大大降低治疗的费用。当然,这一目标的实现基于产品安全性的提升和医生日益增长的专业知识。而MD安德森癌症中心也开发了一套简单的CAR-T毒性框架指南,有望尽早发现药物毒性,针对耐受性良好的患者有望推广门诊输注疗法。
二、全球上市CAR-T细胞疗法
截至6月2日,全球已有5款CAR-T细胞疗法获批上市,包括四款靶向CD19和一款靶向BCMA的CAR-T细胞疗法。在CAR-T领域,诺华(NVS.US)、Kite Pharma和Juno(JUNO.US)可谓“三巨头”,在五款上市CAR-T产品中,四款与“三巨头”有密切关系。此外,全球超过700项CAR-T临床项目在ClinicalTrials注册,治疗领域以血液肿瘤为主,也包括实体瘤适应症,如肝癌、肺癌、乳腺癌、结直肠癌、胃癌等。
(一)Kymriah:全球首款获批上市CAR-T疗法
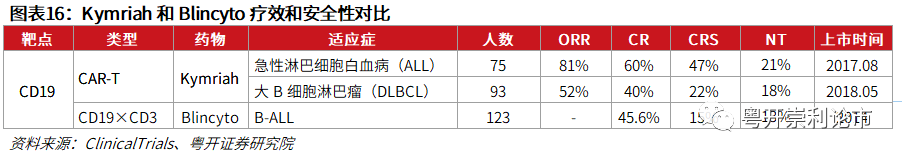
Kymriah(tisagenlecleucel,CTL019)由诺华研发,2017年8月获FDA批准上市,用于治疗B细胞前体急性淋巴性白血病(ALL),且病情难治或出现两次及以上复发的25岁以下患者;2018年,Kymriah获批复发或难治性大B细胞淋巴瘤的成人患者适应症,Kymriah为全球首款获批上市CAR-T疗法。
Kymriah属于第二代CAR-T细胞疗法,使用4-1BB作为共刺激结合域,4-1BB可持续激活下游通路,作用的持久性对于复发的病情可能存在更好的控制力。
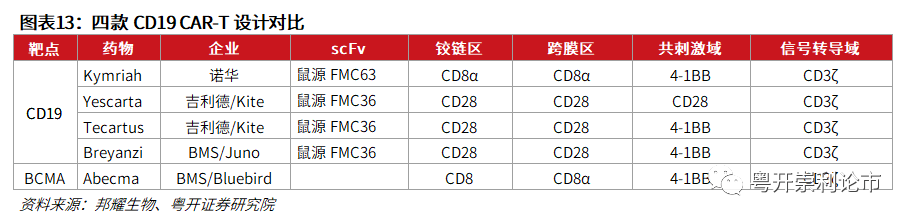
Kymriah2020年全球销售额达4.74亿美元,同比增长68%。定价方面,Kymriah白血病适应症费用为47.5万美元,淋巴瘤适应症费用为37.3万美元。尽管价格昂贵,但2020年即使在疫情的背景下,Kymriah依然实现了4.74亿美元的销售额,同比增长68%。2020年增速显著得益于近年来诺华大幅提升了Kymriah的制备效率,分别在美国、瑞士、德国、中国等地加速设厂,而凭借诺华卓越的药物推广能力,Kymriah未来销售额有望超越Yescarta。在诺华2021年的业绩展望中,已将Kymriah视为未来业绩增长的关键推动力。
在国内,2018年,诺华和西比曼生物(CBMG.US)达成战略合作协议,西比曼生物负责在中国生产和供应Kymriah,诺华公司将成为营销许可的独家持有人。2019年10月30日,Kymriah 在中国获批临床,适应症为复发性或难治性侵袭性 B-细胞非霍奇金淋巴瘤,目前处于临床Ⅲ期。

试验数据:
(1)B细胞前体急性淋巴性白血病(ALL)
全球25个研究中心,对75名晚期B细胞淋巴性白血病患者接受Kymriah治疗后,进行了3个月或更长时间的随访。
疗效数据:结果显示,81%的患者达到了客观缓解 (95%CI:71%-89%),80%的应答者在6个月时仍处于缓解期。60%的患者达到完全缓解(CR),21%的患者达到不完全血细胞计数恢复(CRi)的PR。在那些缓解的患者中,100%没有在骨髓中检测到微小残留病(MRD)。总生存期(OS)在6个月时为90%,在12个月时为76%。在这个难以治疗的患者群体中,中位OS为19.1个月(95%CI:15.2-NE)。
安全性数据:47%的患者发生过3-4级的细胞因子风暴,两个死亡病例。13%的患者经历了3-4级神经相关的副作用,没有脑水肿产生。
(2)成人复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)
DLBCL是我国人群中最常见的淋巴瘤类型,占所有淋巴瘤的33.27%。临床多发于成年人和老年人,儿童少见,临床表现为迅速增大的无痛性肿块,恶性程度较高,但对化疗反应较好。
疗效数据:在一项名为JULIET的研究中,共招募了93名DLBCL成人患者,数据显示,这93名患者的总体有效率(ORR)为52%(95% [CI],41%-62%),其中40%为完全缓解(CR),12%为部分缓解(PR),同时,在接受治疗后的第3个月实现完全缓解的所有患者中,能够将CR状态维持到第12个月的患者比例为80%,而中位的应答持续期数据尚未成熟。
生存期方面,在所有接受细胞输注的患者(n =111)(95%CI,6.6-NE)中,12个月的OS率为49%,中位OS为11.7个月。从输注到数据截止的中位时间为14个月,最长输注时长为23个月。在数据截止时,Kymriah治疗后没有一个患者接受干细胞移植。
安全性数据:在输注Kymriah之后8周内,发生3/4级细胞因子风暴(CRS)的患者比例为22%(3级14%,4级8%),15%的患者(包括发生2级CRS患者中的3%和发生3级CRS患者中的50%)接受了托珠单抗来对抗CRS,研究中未见报道发生脑水肿相关的死亡信息。
(二)Yescarta:有望成为国内首个获批上市的CAR-T细胞疗法
Yescarta(axicabtagene ciloleucel,KTE-C19,FKC876)是一款由吉利德(GILD.US)/Kite Pharma研发的靶向CD19的CAR-T细胞疗法,2017年获FDA批准用于既往接受二线或多线系统治疗的复发性或难治性弥漫性大B细胞淋巴瘤(DLBCL)成人患者的治疗;2021年3月5日,Yescarta获批用于治疗已接受过2种或更多种系统治疗方案的复发性或难治性滤泡性淋巴瘤(FL)成人患者。
2017年8月,吉利德科学以119亿美元收购Kite Pharma,并获得了Kite旗下Yescarta的权益。
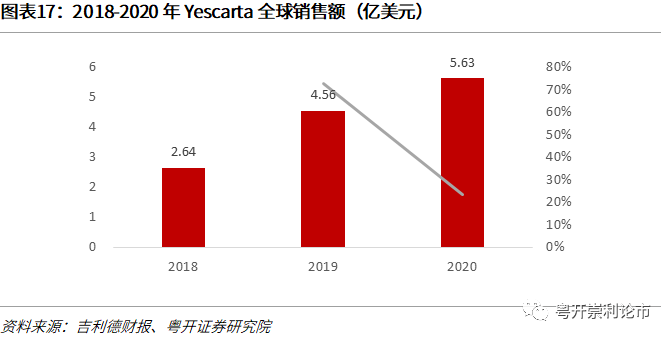
Yescarta2020年全球销售额达5.63亿美元,同比增长23%。定价方面,Yescarta在美国市场的定价为37.3万美元,与Kymriah的DLBCL适应症定价相同。2020年,受Kymriah冲击,Yescarta销售额达5.63亿美元,增速放缓,同比增长23%。值得一提的是,Kite公司CAR-T细胞产品制备优势明显,在ZUMA-2试验中便展示了96%的制造成功率及平均15天的产品交付周期,对于晚期肿瘤患者十分关键,但这一优势随着诺华等公司CAR-T细胞制备技术的提升正逐步缩小。
国内复星凯特拥有Yescarta大中华区权益,2021年初已提交上市申请。2017年1月,复星医药发布公告,通过子公司复星凯特投资不超过8000万美元,与Kite Pharma共同设立复星凯特,以开拓Yescarta国内市场。2020年2月,复星凯特向NMPA递交Yescarta的上市申请,用于治疗DLBCL。2021年1月12日,复星凯特的CD19CAR-T疗法益基利仑赛注射液(Yescarta)在中国的上市申请处于“在审批”阶段,有望于近期获NMPA批准上市,或成为国内首个上市的CAR-T疗法。
试验数据:
(1)弥散性大B细胞淋巴瘤(DLBCL)
Yescarta DLBCL适应症的获批基于关键性临床研究ZUMA-1的积极数据。
疗效数据:共101例患者接受了Yescarta单次输注,其中72%的患者表现出缓解(总缓解率),51%的患者未检测到癌症残留(完全缓解率:95%CI:41-62)。在ASH2020上,吉利德披露在ZUMA-1试验中,患者的总生存期(OS)超过两年,而DLBCL患者接受化疗的生存期仅为6个月。
安全性数据:该研究中有13%的患者经历了3级或更高级别的细胞因子释放综合征(CRS),31%的患者经历了神经系统毒性。常见的(≥10%)3级或更高级别反应包括:发热性中性粒细胞减少、发烧、CRS、脑病、病原菌不明感染、低血压、低氧血症、肺部感染。严重不良反应发生于52%的患者,包括:CRS、神经毒性、延长的血细胞减少(包括中性粒细胞减少、血细胞减少、贫血)和严重感染。该研究中发生了CRS和神经毒性致死病例。
(2)滤泡性淋巴瘤(FL)
滤泡性淋巴瘤(FL)是一种惰性非霍奇金淋巴瘤(iNHL),是全球第二大常见的淋巴瘤类型,约占全世界诊断的所有淋巴瘤的22%。FL生长缓慢、但随着时间的推移侵袭性极强。目前,对于已接受过2种或2种以上系统治疗方案的复发性或难治性惰性FL患者,治疗选择有限。
疗效数据:FL适应症的获批基于ZUMA-5临床研究的结果,试验共纳入146例复发或难治性惰性非霍奇金淋巴瘤(iNHL)患者。试验结果显示,91%的FL患者对单次输注Yescarta表现出治疗反应,ORR达91%;其中,60%的患者病情获得完全缓解(CR)。
安全性数据:在146例可评价安全性的患者中,有8%和21%的患者观察到3级或更高疾病的细胞因子释放综合征(CRS)和神经系统毒性。CRS和神经系统毒性的中位发病时间分别为4天(1-20天)和6天(1-79天)。最常见的(≥10%)3级或以上级别的不良反应包括发热性中性粒细胞减少、脑病和不明病原体感染。
(三)Tecartus:首款治疗MCL的CAR-T细胞疗法
Tecartus(brexucabtageneautoleucel,KTE-X19)是一款由吉利德/KitePharma研发靶向CD19的CAR-T细胞疗法,T细胞内使用了4-1BB共刺激域。Tecartus采用了XLP制造工艺,XLP制造工艺是Kite公司特有的T细胞筛选和淋巴细胞富集方法。2020年7月,FDA批准Tecartus用于治疗复发或难治性套细胞淋巴瘤(MCL)成人患者。定价方面,Tecartus的MCL适应症定价为37.3万美元。
试验数据:
(1)复发性/难治性套细胞淋巴瘤(R/R MCL)
套细胞淋巴瘤(MCL)是非霍奇金淋巴瘤(NHL)的一个罕见亚型,由淋巴结套区的细胞癌变引起,常见于60岁以上的男性。MCL在复发后具有高度侵袭性。在中国,MCL新发患者数约占NHL的3.5%,每年新发患者数约3100例。
Tecartus的批准基于Ⅱ期ZUMA-2试验数据,试验入组74例R/R MCL患者。这些患者的疾病对5种先前的治疗方案(包括基于蒽环类药物或苯达莫司汀的化疗方案,抗CD20单克隆抗体药物,BTK抑制剂ibrutinib或acalabrutinib)无效或复发。
疗效数据:Tecartus单次输注治疗的ORR为87%(n=60例可评估疗效分析)、CR为62%。
安全性数据:18%的患者(n=82例安全性评估)经历了≥3级细胞因子释放综合征(CRS),37%的患者经历了神经系统事件。最常见(≥10%)≥3级不良反应为贫血、中性粒细胞减少症、血小板减少症、低血压、低磷血症、脑病、白细胞减少症、缺氧、发热、低钠血症、高血压、不明感染病原体、肺炎、低钙血症和淋巴细胞减少症。
(四)Breyanzi:安全性最高的上市CD19 CAR-T产品
Breyanzi(lisocabtagenemaraleucel,JCAR017)是BMS旗下一款靶向CD19的CAR-T产品,2021年2月,美国FDA批准Breyanzi用于弥散性大B细胞淋巴瘤成年患者的治疗(DLBCL)。Breyanzi通过一个CAR结构靶向CD19的表达,该结构包括一个用于T细胞增殖和保存的4-1BB共刺激结构域,一个CD3-zt细胞激活结构域,以及一个用于抗原特异性的抗CD19单链可变片段靶向结构域。Breyanzi定价为41.03万美元。
2018年1月,新基(Celgene)斥资90亿美元收购Juno Therapeutics;2019年1月,BMS以740亿美元收购新基,上演了一场“大鱼吃小鱼”的好戏。最终BMS收获了CAR-T品种Breyanzi。
试验数据:
(1)弥散性大B细胞淋巴瘤(DLBCL)
Breyanzi的获批上市基于TRANSCEND NHL001临床试验。
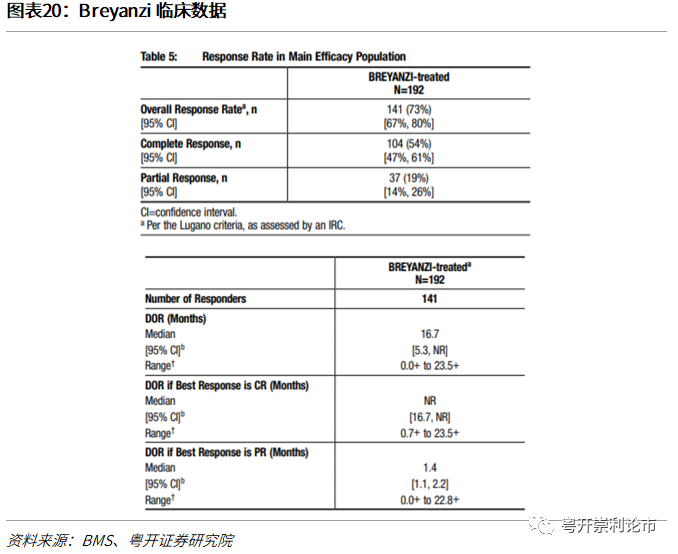
疗效数据:试验结果表明,在可评估疗效的192例患者中,73%(95%CI:67%-80%)实现缓解,其中完全缓解率为54%(CR;95%CI:47%-61%),部分缓解率为19%(PR;95%CI:14%-26%)。所有产生应答的患者中,中位缓解持续时间为16.7个月(95%CI:5.3-NR);实现CR的患者中,中位缓解持续时间未达到(95%CI:16.7-NR);对于最佳应答为PR的患者,中位缓解持续时间为1.4个月(95%CI:1.1-2.2)。接受Breyanzi治疗且最佳总体应答为CR的104位患者中,65%缓解持续至少六个月,62%缓解持续至少9个月。
安全性数据:对268例接受Breyanzi治疗的患者进行了安全性评估。使用Lee氏分级,46%(122/268)的患者发生CRS,其中3级及以上CRS出现在4%(11/268)的患者中。死亡时,一名患者发生致命的CRS,两名患者在经历CRS。CRS最常见的表现包括发烧(93%)、低血压(49%)、心动过速(39%)、畏寒(28%)和缺氧(21%)。CRS中位持续时间为5天,中位发作时间为5天。
接受Breyanzi治疗的患者中,35%(95/268)发生了神经毒性(NT),其中3级及以上NT出现在12%(31/268)的患者中。死亡时,一名患者发生致命的NT,七名患者在经历NT。最常见的NT包括脑病(24%)、震颤(14%)、失语症(9%)、谵妄(7%)、头痛(7%)、共济失调(6%)和头晕(6%)。95名患者中有81名(85%)的NT被解决,中位持续时间为12天,中位发作时间为8天。所有患者NT中位持续时间为15天,包括死亡或数据截止时仍在经历的患者。
(五)Abecma:全球首款获批上市BCMA CAR-T疗法
BCMA(B-cell Maturation Antigen)属于肿瘤坏死因子受体家族成员,被称为肿瘤坏死因子受体超家族成员17(TNFRSF17),又名B细胞成熟抗原。BCMA主要表达于晚期B细胞、短寿命增殖浆母细胞和长寿命浆细胞表面,而在初始B细胞、CD34阳性造血干细胞和其他正常组织细胞中不表达。凭借其在晚期B细胞表面的特异性表达,BCMA成为了多发性骨髓瘤良好的诊断标志物和治疗靶点。
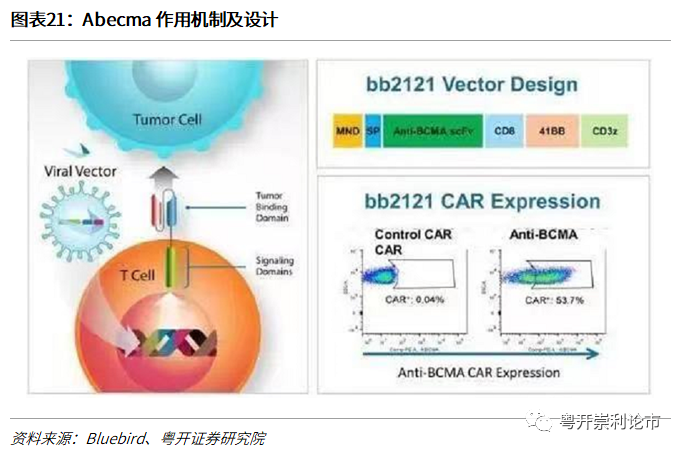
Abecma(idecabtagene vicleucel,bb2121)是BMS(BMS.US)和Bluebird公司(BLUE.US)联合开发的、首个获批上市的靶向B细胞成熟抗原(BCMA)的CAR-T疗法。2021年3月,Abecma获FDA批准用于既往接受过四种或更多种疗法(包括3类药物:免疫调节剂、蛋白酶体抑制剂、抗CD38抗体)的复发性/难治性多发性骨髓瘤(r/r MM)的成人患者。
Abecma定价为41.95万美元,行业内预计Abecma销售峰值为6.29亿美元。这一预估基于Abercma作为治疗MM的5线疗法,适应人群十分有限。这也为强生/传奇生物的BCMA CAR-T疗法留下较大的空间,即通过更前线的适应症抢占BCMA CAR-T市场。
试验数据:
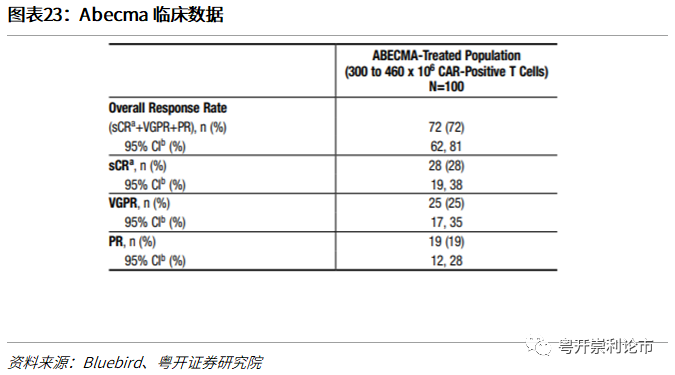
(1)多发性骨髓瘤(MM)
Abecma的获批上市基于名为KarMMa的关键性Ⅱ期临床试验。该试验对127例复发/难治性多发性骨髓瘤患者进行了治疗,这些患者至少接受了三种前期疗法。
疗效数据:试验结果表明,可评估疗效人群的总缓解率(ORR)为72%,其中CR达28%,数据十分亮眼。从疗效数据的角度,Abecma作为一款靶向BCMA的CAR-T疗法,疗效显著优于CD3×BCMA的双抗疗法。
安全性数据:所有接受Abecma治疗的患者中,安全性状况良好,主要发生低水平的细胞因子释放综合征(CRS)和神经毒性(NT),并且具有可预测的早期发作和缓解。使用Lee评分系统,CRS的发生率为85%(108/127),≥3级CRS的发生率为9%(12/127),其中一名患者发生5级CRS。NT的发生率为28%(36/127),≥3级NT的发生率为4%(5/127),一名患者死亡的时候正在经历NT。
三、国内CAR-T细胞疗法企业布局
尽管国内目前尚无CAR-T产品获批上市,但CAR-T产品的研发热情极高,研发呈现此起彼伏的态势。据毕马威统计,2020年国内已有335个正在进行的CAR-T临床试验,其中临床居前的包括传奇生物、药名巨诺、复星凯特、科济生物等,涉及的靶点包括CD19、BCMA、CD4等血液肿瘤靶点及Claudin 18.2、GPC3、MSLN等实体瘤靶点。本文作为CAR-T深度报告系列的首篇,简要概述国内CAR-T产品的最新临床进展,国内企业具体的研发进展请关注《CAR-T深度报告(二):国内CAR-T细胞疗法梳理》。
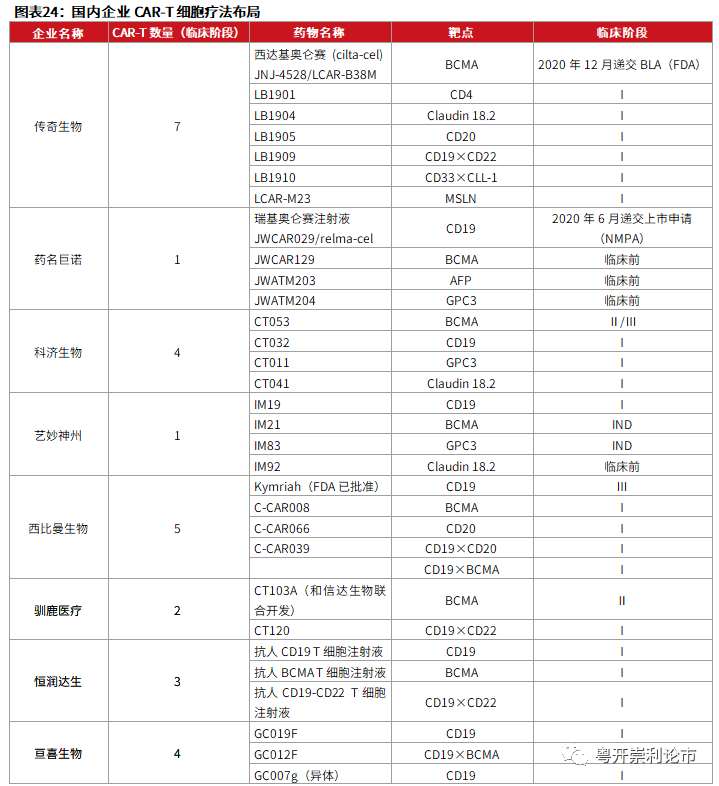
传奇生物(LEGN.O):传奇生物拥有7款处于临床阶段的CAR-T细胞疗法。其中,JNJ-4528是传奇生物与强生联合开发的一款靶向BCMA的CAR-T产品,已于2020年12月向FDA递交了BLA申请,有望于2021年Q3-Q4上市。在2021年6月召开的ASCO大会上,传奇生物公布了JNJ-4528的最新研究结果,JNJ-4528四线治疗MM总ORR达98%,sCR达80%,18个月PFS率达66%,总OS达81%,数据十分亮眼。
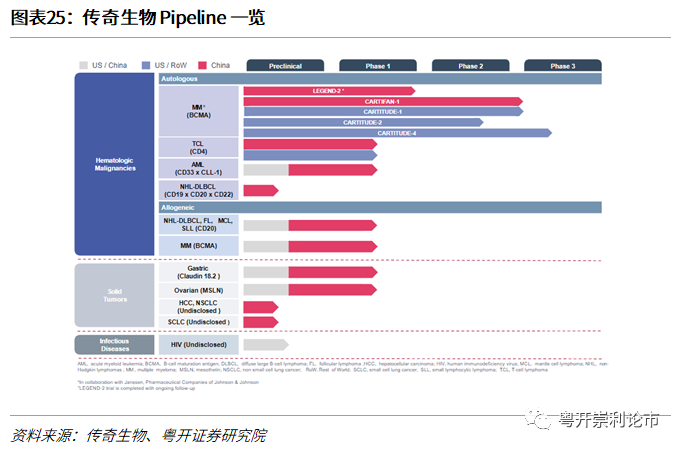
复星凯特:复星凯特生物为复星医药集团(600196)与美国Kite Pharma(吉利德旗下公司)的合营企业,2017年4月于中国上海注册成立。公司立足于自主研发和技术转移相结合,致力于肿瘤免疫细胞治疗技术的产业化和规范化。2020年2月,复星凯特向NMPA递交Yescarta的上市申请,用于治疗DLBCL。2021年1月12日,复星凯特的CD19 CAR-T疗法益基利仑赛注射液(Yescarta)在中国的上市申请处于“在审批”阶段,有望于近期获NMPA批准上市,或成为国内首个上市的CAR-T疗法。
Yescarta作为五款已上市的CAR-T疗法之一,疗效和安全性得到验证。我们预计Yescarta在国内的上市之路将十分顺利,从先前披露的临床数据看,Yescarta总ORR达83%,CR达58%,较传统化疗方法显著延长了患者的OS,有望为晚期DLBCL患者提供新的用药选择。
科济药业(2171.HK):科济药业(2171.HK)是一家专注于研发治疗血液恶性肿瘤和实体瘤的创新CAR-T细胞疗法。自2014年以来,公司已开发多项新技术以及拥有全球权益的产品管线,以解决CAR-T细胞疗法面临的重大挑战,如安全性、疗效和成本等。公司目前拥有四款处于临床阶段的CAR-T产品,其中CT053为一款靶向BCMA的CAR-T产品,目前处于Ⅱ/Ⅲ期,有望成为安全性最高的BCMA CAR-T产品。

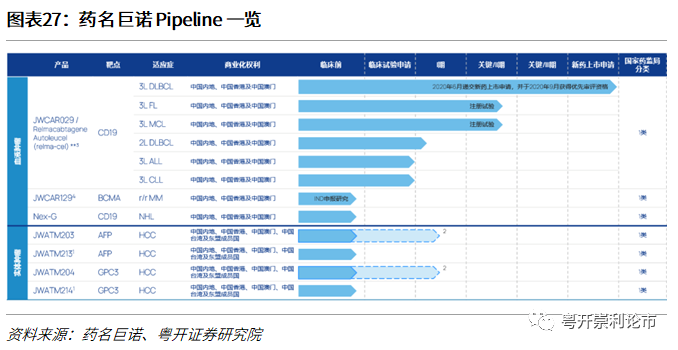
药名巨诺(2126.HK):药名巨诺由药明康德(02359)与Juno(BMS下属子公司)联合创建,专注于血液及实体瘤细胞疗法的研发。公司拥有多款CAR-T细胞疗法产品,绝大多数处于临床前阶段,其中,Relma-cel是一款靶点CD19的CAR-T疗法。2020年6月,药名巨诺向NMPA递交了Relma-cel作为弥散性大B细胞淋巴瘤(DLBCL)的上市申请。
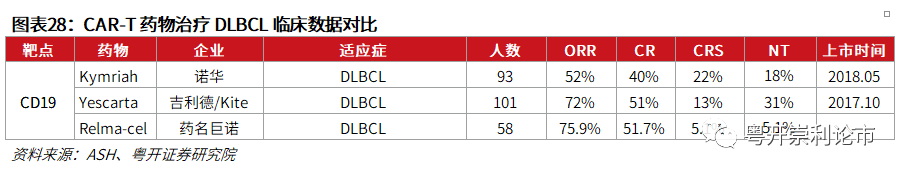
在2020年ASH年会上,药名巨诺公布了Relma-cel用于治疗DLBCL的关键性临床数据,试验结果表明,Relma-cel总ORR为75.9%,CR为51.7%,6个月DoR、PFS和OS分别为60%、54.2%和90.8%。从实验数据分析,Relma-cel有望成CD19 CAR-T的Best-in-class。
四、风险提示
药物临床风险、商业化风险、研发同质化风险。
本文编选自微信公众号“粤开崇利论市”;智通财经编辑:楚芸玮。





