智通财经APP获悉,7月3日,根据中国国家药监局药品审评中心公示,再鼎医药(ZLAB.US)与再生元(REGN.US)共同申报的REGN1979注射液的5项临床申请已获得受理。
据悉,REGN1979是一款CD20xCD3双特异性抗体,再鼎医药于今年4月以高达1.9亿美元的金额从再生元引进,获得了其在大中华区的开发和独家商业化权益。此次申报临床并获受理,是双方宣布合作后取得的新进展。
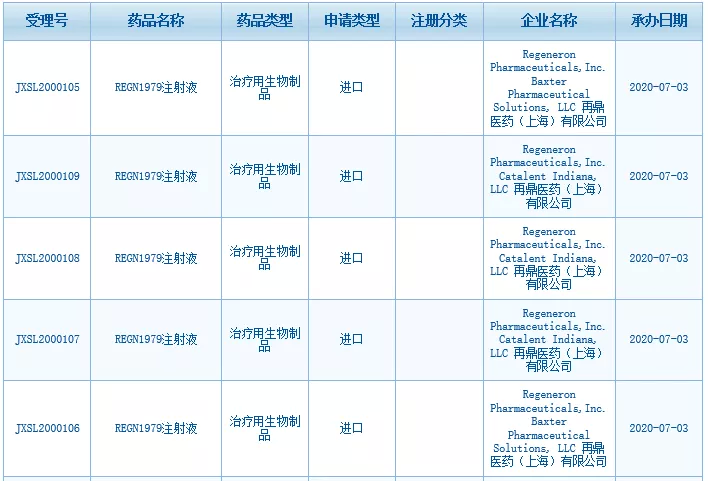
图片来源:CDE官网截图
REGN1979是通过再生元双特异性抗体平台开发的一款双特异性单克隆抗体,旨在通过与B细胞肿瘤蛋白(CD20)和免疫系统T细胞受体(CD3)结合来杀伤癌细胞。早前,REGN1979已被美国FDA授予孤儿药资格,用于治疗弥漫性大B细胞淋巴瘤(DLBCL)和滤泡性淋巴瘤(FL)。在全球,REGN1979正在晚期滤泡性淋巴瘤、弥漫性大B细胞淋巴瘤和其它淋巴瘤患者中开展多项临床研究。






