智通财经APP获悉,根据中国国家药监局药品审评中心(CDE)网站最新公示,5月10日,赛诺菲(SNY.US)旗下的isatuximab注射液在中国提交了两项新的临床试验申请。
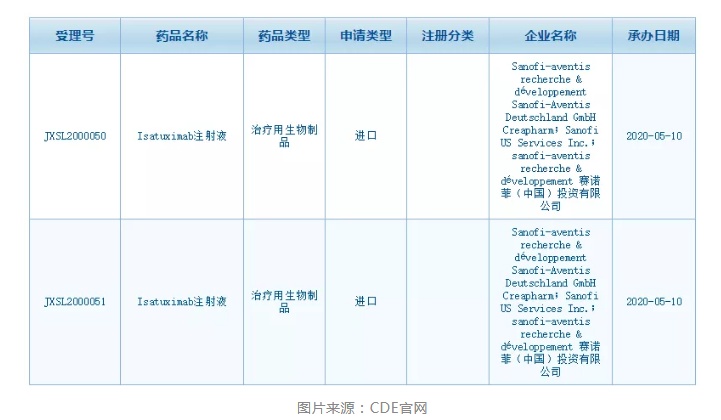
在中国,赛诺菲最早于2017年提交了一项isatuximab注射液的临床试验申请,本次是该药第二次在中国提交临床试验。根据中国药物临床试验登记与信息公示平台,赛诺菲正在多发性骨髓瘤患者中开展两项临床试验。
据了解,Isatuximab是一款CD38抗体,该药在今年3月刚获美国FDA批准上市,联合其它药物治疗成年多发性骨髓瘤(MM)患者。这也是继强生的达雷妥尤单抗后,全球范围内第2款获得美国FDA批准上市的CD38抗体药物。
Isatuximab在美国的获批是基于一项包含307名复发、难治性多发性骨髓瘤患者的临床试验,这些患者接受过至少两次前期疗法的治疗。试验结果表明,与泊马度胺和低剂量地塞米松构成的活性对照组相比,isatuximab与泊马度胺和低剂量地塞米松联合显著提高了患者的治疗效果。