4月23日晚,礼来发布了2020年第一季度财报。据披露,今年Q1季度,礼来营收58.60亿美元,同比增长15%,可谓十分强劲。一方面,受2014年以来上市的药物Trulicity、Taltz、Verzenio、Jardiance、Emgality等的销售增长推动;另一方面 ,受新冠疫情影响,人们的药物购买需求增加,带来了约2.5亿美元的收入增长。
1、近5年上市的新药是礼来的增长引擎据
礼来财报显示,Trulicity、Taltz、Verzenio、Jardiance、Emgality、Olumiant、Basaglar、Tyvyt、Cyramza和Baqsimi这10款药物贡献的收入增长最大,药物销售总额约占总营收的51%,而销售总额同比增长了约19.9%。可以说近5年上市的新药是礼来的增长引擎。
图表1:影响全球销售额增长的产品情况
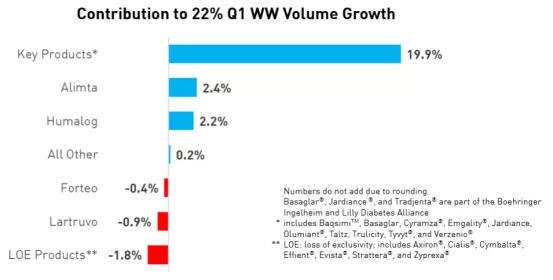
来源:礼来财报,中康产业资本研究中心
图表2:关键增长产品Q1季度情况

来源:礼来财报,中康产业资本研究中心
其中,银屑病药Taltz、乳腺癌药Verzenio及类风湿关节炎药Olumiant的销售额同比增长均超过了70%,销售收入分别为4.44亿美元、1.88亿美元及1.40亿美元。另外,偏头痛药Emgality和经典霍奇金淋巴瘤药Tyvyt的销售增长也较多。Tyvyt(达伯舒)是礼来与信达生物合作开发的药物,据两家今日发布的公告,NMPA已经正式受理该药用于非鳞状非小细胞肺癌一线治疗的新适应症申请。同时,该药是目前唯一进入我国国家医保目录的PD-1单抗产品,值得期待。
另外,礼来销售额第一的产品Trulicity(度拉糖肽)在今年第一季度的销售额达12.29亿美元,同比增长40%。Trulicity是礼来目前的王牌产品,Q1季度贡献了近21%的收入,销售额远高于其他产品。其实,从Trulicity于2014年9月上市以来,其销售额就在一路飙升。
从礼来的产品情况看,公司在深耕糖尿病领域,而同样专注于糖尿病的诺和诺德是其主要的竞争对手。至于销售额下滑的主要产品,如糖尿病成熟产品Humulin销售额下滑5%至6.96亿美元、治疗骨质疏松的Forteo销售额下滑13%至2.72亿美元,主要是受到仿制药竞争的影响。另外,用于勃起功能障碍的Cialis、糖尿病药物Trajenta(利格列汀)及注意力缺陷多动障碍药物Strattera的销售额也有较大下滑,不过由于占营收的比例不大,因此对整体影响较小。
图表3:礼来2020Q1季度药品销售情况
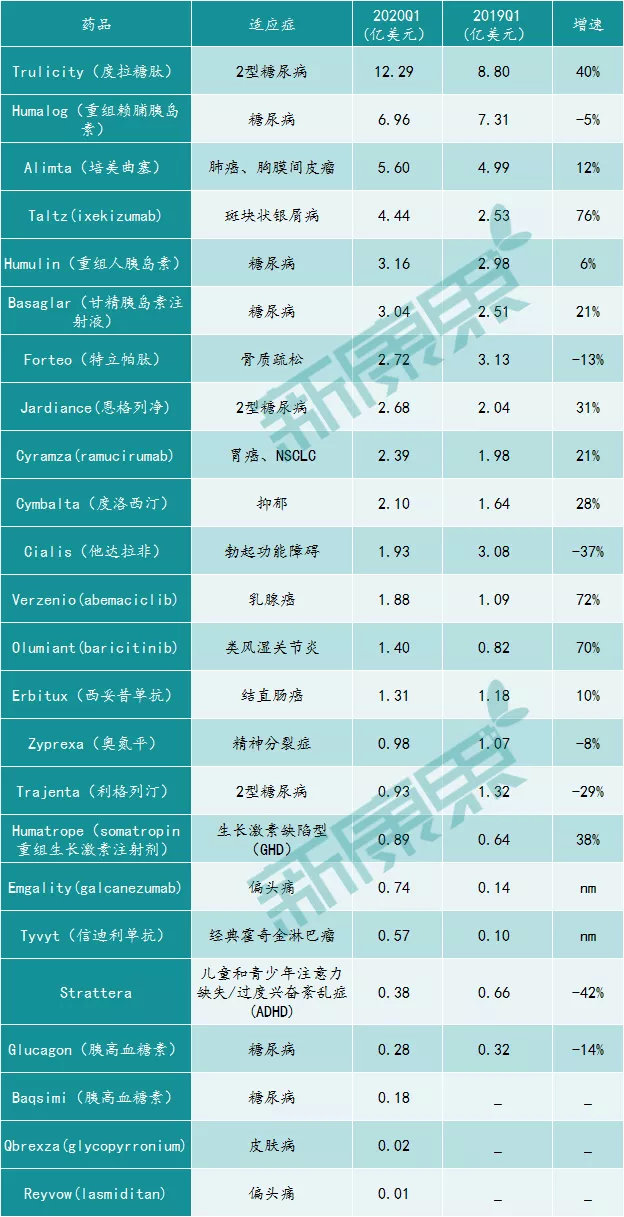
来源:礼来财报,中康产业资本研究中心
2、公共卫生事件推动人们购药需求,但研发活动受阻
公共卫生事件的不断蔓延,导致人们的用药需求增加。而受益于此,礼来全球业绩额外增加了2.5亿美元,其中,美国区就贡献了2亿美元。在应对方面,礼来分别与国家过敏和传染病研究所(NIAID)及AbCellera签订了协议,与前者共同研发Baricitinib(巴瑞替尼) 用于治疗COVID-19,而与后者则计划共同开发用于潜在治疗和预防COVID-19的抗体产品。
图表4:礼来在研的潜在COVID-19治疗产品

来源:礼来财报,中康产业资本研究中心
另外,由于公共卫生事件形势严峻,礼来在3月宣布延迟启动大多数新研究,并暂停多数正在进行研究的注册。而对于已经在进行中的临床试验,患者将继续接受治疗。
3、最新在研管线一览礼来的产品管线较为丰富
目前,其有临床Ⅰ期项目27个、临床Ⅱ期项目10个、临床Ⅲ期项目15个、等待获批上市的产品有9个。
图表5:礼来最新在研管线
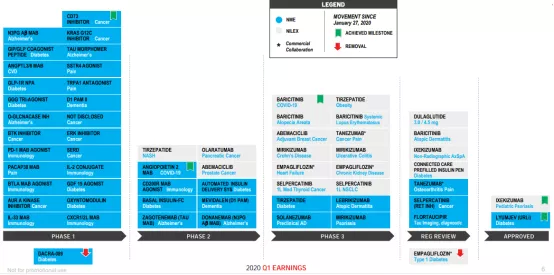
来源:礼来财报,中康产业资本研究中心
其中,Taltz(ixekizumab)已获FDA批准用于治疗6-17岁患者的中度至重度斑块状牛皮癣,适应症进一步拓展;URLi(速效赖脯胰岛素)获欧盟CHMP推荐批准,用作每日多次注射方案的一部分或由胰岛素泵给药,用于治疗糖尿病成人患者。
除了欧盟之外,礼来也已向美国和日本的监管机构提交了URLi的上市申请。另外,用于特应性皮炎的Baricitinib、骨关节炎疼痛的NGF抑制剂Tanezumab等7款产品还在注册审查中。
值得注意的是,该管线中有两项被移除的产品,均是糖尿病药物:DACRA-089和Empagliflozin(恩格列净)。前者是临床Ⅰ期产品,后者则处于上市申请阶段。Empagliflozin是礼来与勃林格殷格翰合作开发的产品,目前已上市用于2型糖尿病成人患者的治疗。
不过,今年3月份,FDA拒绝了该药用于1型糖尿病的申请。FDA在CRL中表示无法批准目前形式的申请,这与2019年11月FDA内分泌和代谢药物咨询委员会(EMDAC)的投票结果一致:Empagliflozin 2.5mg作为胰岛素的辅助药物治疗T1D成人患者的益处不大于风险,数据不支持其批准。据了解,美国至今尚无SGLT抑制剂获批T1D适应症,但在欧盟和日本已有多款产品获批。
另外,在今年第一季度,Mirikizumab用于中度至重度斑块状牛皮癣的3期临床试验在OASIS-1中达到了主要和次要终点,预计OASIS-2试验将于2020年晚些时候完成;Taltz用于中度至重度牛皮癣患者的4期研究IXORA-R已完成。
(编辑:文文)






