本文来自微信公众号“医药魔方Info”。
4月6日,Millendo Therapeutics(MLND.US)宣布因IIb期ZEPHYR研究失败,公司将终止其非酰化胃饥饿素类似物livoletide用于治疗Prader-Willi综合征的开发。
ZEPHYR研究是一项分为两个阶段的随机、双盲、安慰剂对照的IIb/III期临床试验。此次失败的关键性IIb期研究共涉及158例患者,结果表明,接受60µg/kg、120µg/kg livoletide治疗12周的患者HQ-CT(临床试验食欲亢进问卷)评分较基线期有所改善,分别为-4.7(p=0.13)和-3.8(p=0.45),安慰剂组为-2.8,但没有统计学上的显著差异。在次要终点方面,没有观察到到脂肪质量、体重或腰围的改善。livoletide安全性和耐受性良好,最常见的不良事件为注射部位不良反应。 Prader-Willi综合征是一种罕见的遗传性疾病,该疾病在国外不同人群发病率为1/30000~1/10000。患者在新生儿期主要特征为严重肌张力低下、喂养困难、外生殖器发育不良,婴幼儿期后食欲亢进、肥胖、学习障碍及脾气暴躁。
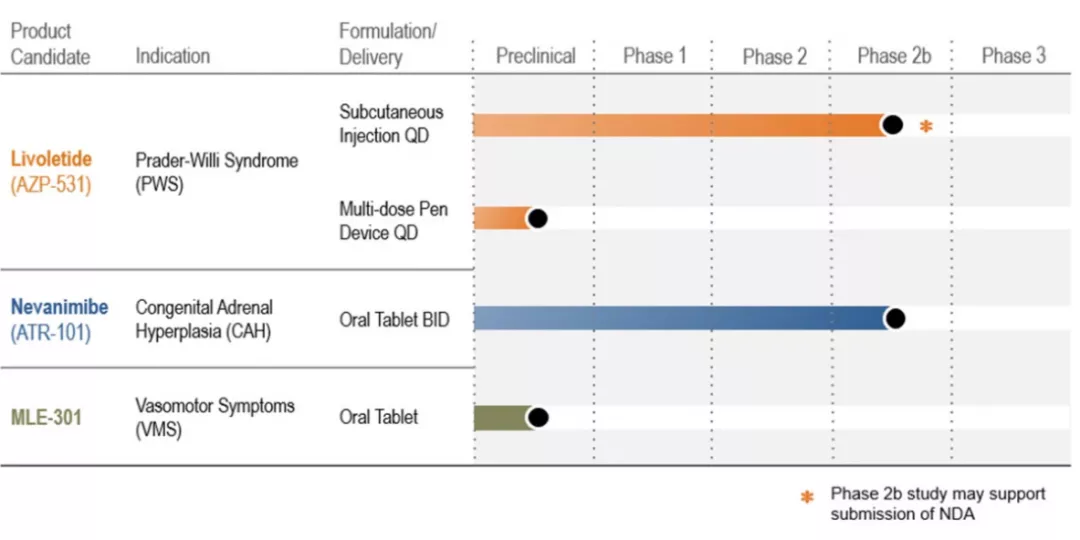
Millendo Therapeutics公司研发管线
Millendo Therapeutics公司表示,livoletide终止开发后,公司将致力于nevanimibe治疗先天性肾上腺皮质增生症和MLE-301治疗血管舒缩症的开发。
(编辑:李国坚)





