本文选自微信公众号“药明康德”。
本周,赛诺菲(Sanofi)、礼来(Eli Lilly and Company)、辉瑞(Pfizer)等大型生物医药公司公布了2019年第二季度的财报。同时,它们也提供了各自药物研发管线的最新信息。今日,药明康德内容团队将结合这些公司的财报和公开资料,与读者分享它们新药研发的最新动向。
![]()
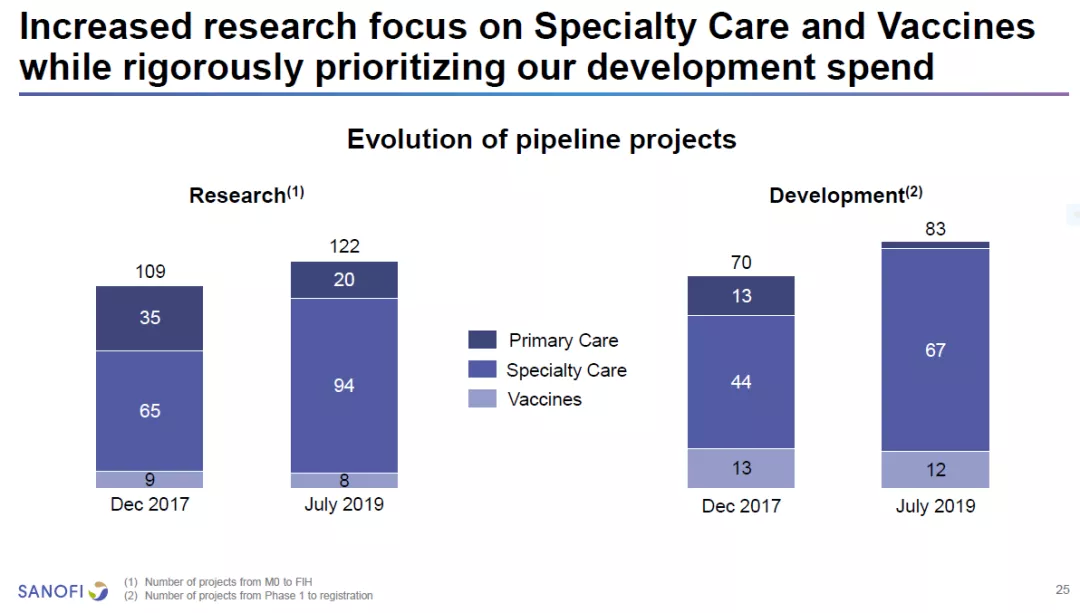
赛诺菲公司在执行副总裁,全球研发负责人John Reed博士的带领下,对公司的研发作出了重大的调整。它将专注于开发专科疗法(Specialty Care)和疫苗,并将投入更多资源开发生物制剂和基因疗法。该公司的长期目标是研发管线中的在研疗法80%为“first-in-class”或“best-in-class”,70%为生物制剂,70%为内部研发产品。预计直到2021年,赛诺菲每年的研发投入将维持在60亿欧元左右。
![]()
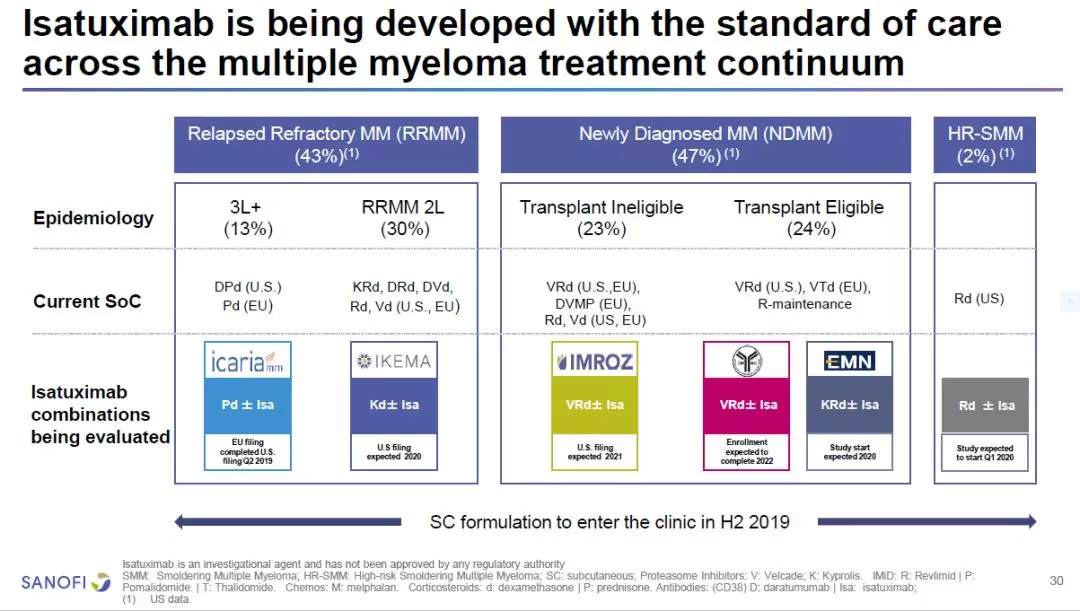
在赛诺菲的研发管线中,治疗复发/难治性多发性骨髓瘤(RRMM)的抗CD38单克隆抗体isatuximab,在关键性3期临床试验ICARIAmm中达到试验临床终点,显著提高了患者的无进展生存期(PFS)。与泊马度胺(pomalidomide)和地塞米松(dexamethasone)联用,它能够将RRMM患者的死亡风险降低40%。赛诺菲已经向美国和欧盟的监管机构递交了新药申请,预计在2020年4月获得美国FDA的回复。
![]()
同时,赛诺菲将启动多项临床试验,检验isatuximab与不同类型的标准疗法组合,治疗处于疾病不同阶段的MM患者的疗效。
图片来源:参考资料[1]
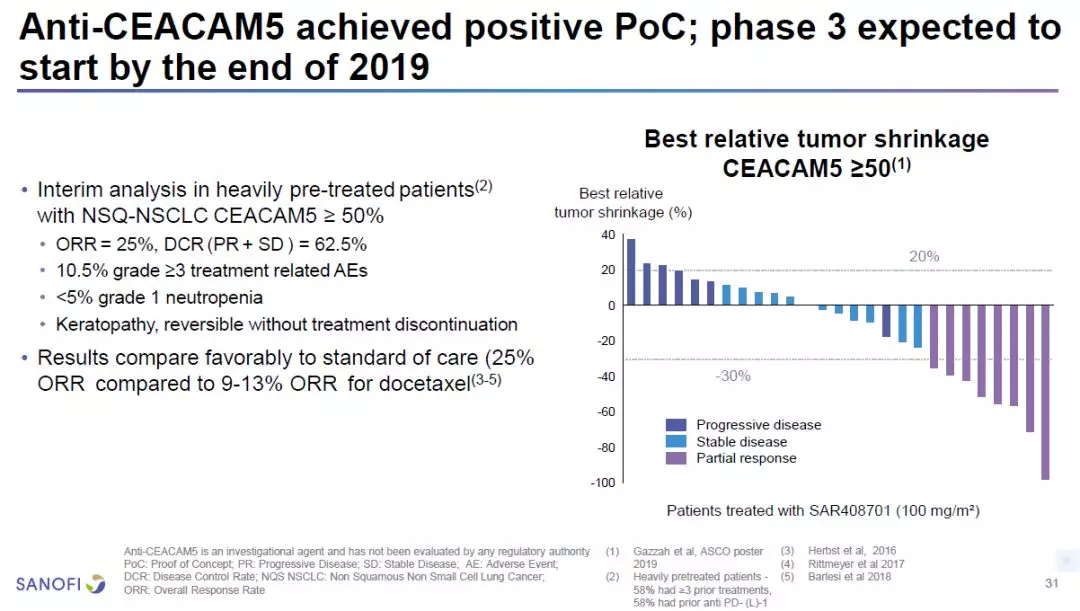
John Reed博士介绍的另一款抗癌疗法是抗CEACAM5抗体偶联药物(ADC)SAR408701。CEACAM5是一种在多种实体瘤中高度表达的细胞表面抗原。在非小细胞肺癌(NSCLC)患者中,有20%患者的肿瘤表达高水平CEACAM5抗原。在1/2期临床试验中,这款ADC的疗效获得概念验证。在接受过多次治疗,并且CEACAM5抗原表达超过50%的非鳞状NSCLC患者中,这款ADC达到25%的客观缓解率(ORR)和62.5%的疾病控制率(DCR)。ORR优于目前的标准疗法(多西他赛,ORR=9-13%)。赛诺菲预计在今年年底启动3期临床试验。
图片来源:参考资料[1]
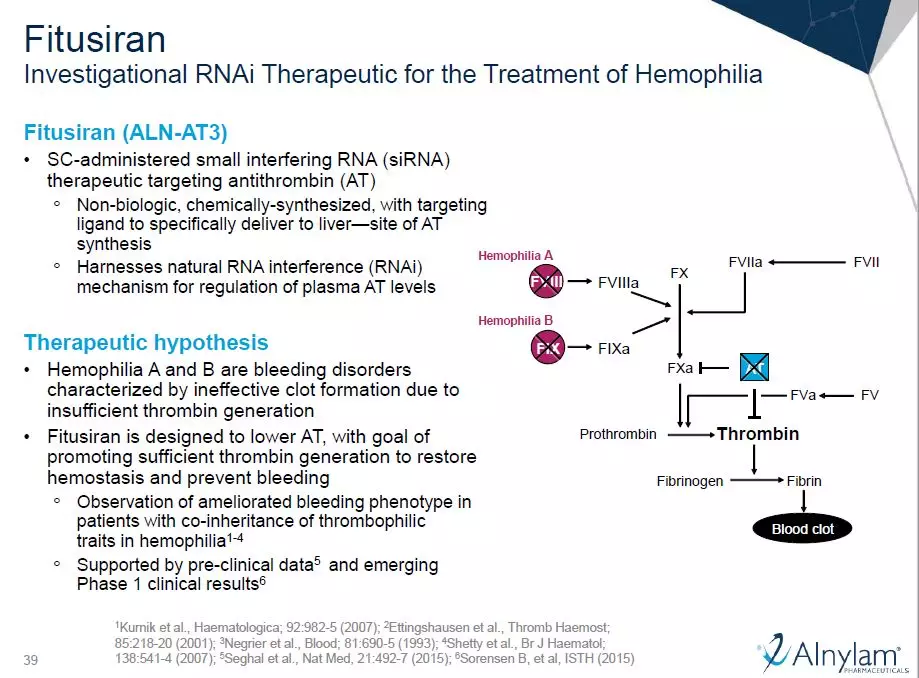
在血液学方面,赛诺菲与Alnylam公司联合开发的fitusiran可能成为一款可治疗A型和B型血友病患者的创新疗法,不管患者体内是否携带凝血因子抑制剂。这是一款RNAi疗法,靶向在凝血级联反应中抑制凝血酶生成的抗凝血酶蛋白。通常,对血友病的治疗方法是补充凝血因子VIII或IX,而这款RNAi疗法另辟蹊径,通过抑制抗凝血酶蛋白,来恢复凝血通路调控的平衡。已有的试验结果表明,这款每月皮下注射一次的RNAi疗法,可以将中位年出血率(ABR)控制在1.08。目前它在名为ATLAS的3期临床试验中接受检验,赛诺菲预计在2020年递交监管申请。
![]()
图片来源:参考资料[2]
![]()
图片来源:参考资料[1]
另一款治疗A型血友病的创新疗法是下一代凝血因子VIII替代疗法BIVV001。这款创新融合蛋白将重组凝血因子VIII与Fc、VWF和XTEN蛋白片段融合在一起,显著延长了因子VIII的半衰期。这一改进让BIVV001在血液中的半衰期超过40小时,是普通重组因子VIII的三倍。赛诺菲将在今年下半年启动3期临床试验。
![]()
图片来源:参考资料[1]
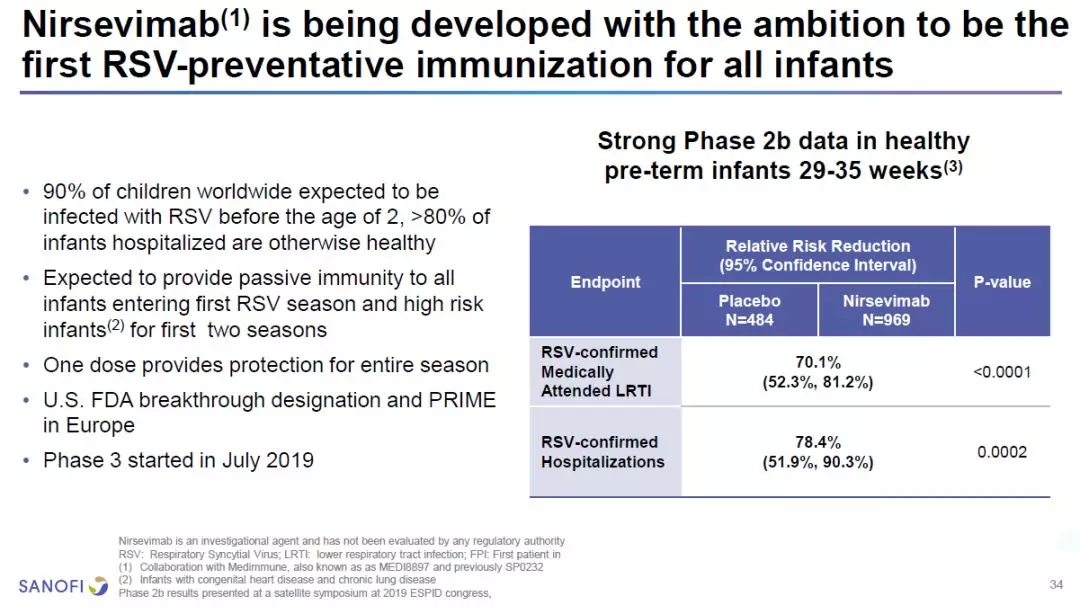
在疫苗开发方面,赛诺菲和阿斯利康(AstraZeneca)共同开发的nirsevimab是一款被动免疫制剂。这是一款靶向呼吸道合胞病毒(RSV)的F单克隆抗体,具有延长的半衰期。世界上90%的儿童在2岁以前可能受到RSV感染。这款被动疫苗在儿童进入RSV季节前注射一次,可以保护他们在长达数月的RSV季节中不受感染。2b期临床试验的数据表明,在健康早产婴儿中,nirsevimab能够将儿童RSV感染风险降低70%。
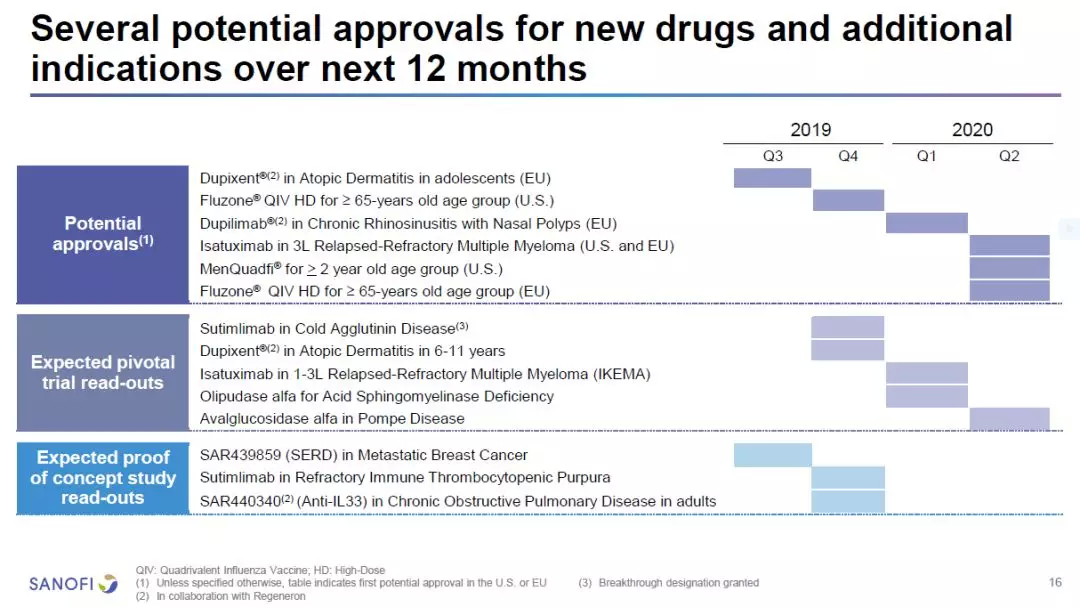
预计在未来的12个月里,赛诺菲可能有6款疗法获得监管批准。
图片来源:参考资料[1]
礼来(LLY.US)
![]()
礼来公司在过去3个月里有三款产品获批,其中VEGFR2抑制剂Cyramza获批作为2线疗法,治疗经过sorafenib治疗,且甲胎蛋白水平高于400 ng/ml的肝细胞癌患者。CGRP抑制剂Emgality获批治疗阵发性丛集性头痛患者。胰高血糖素粉剂Baqsimi获批治疗严重低血糖。
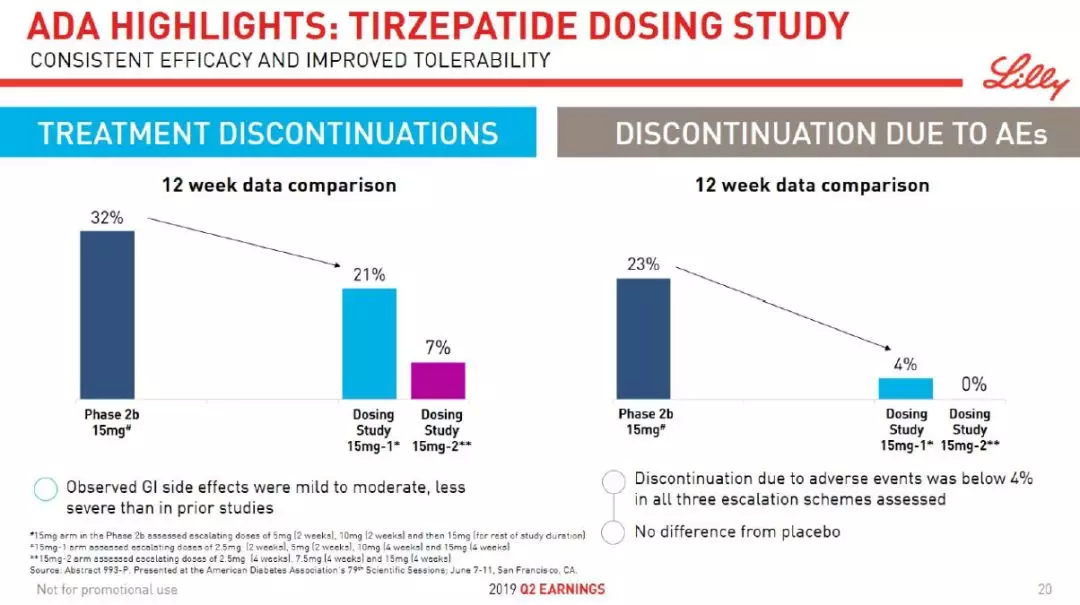
在第二季度财报上,该公司重点介绍了糖尿病疗法tirzepatide和Trulicity的临床试验结果。Tirzepatide是一种多肽类药物,具有胃抑制多肽(GIP)受体和胰高血糖素样肽-1(GLP-1)双重受体激动剂的功效。GIP和GLP-1皆为肠道分泌的能够促进胰岛素分泌的激素。
在第79届美国糖尿病协会(ADA)大会上公布的临床试验结果表明,tirzepatide在有效降低患者糖化血红蛋白(A1C)的同时,显著降低患者的胃肠道副作用。
图片来源:参考资料[3]
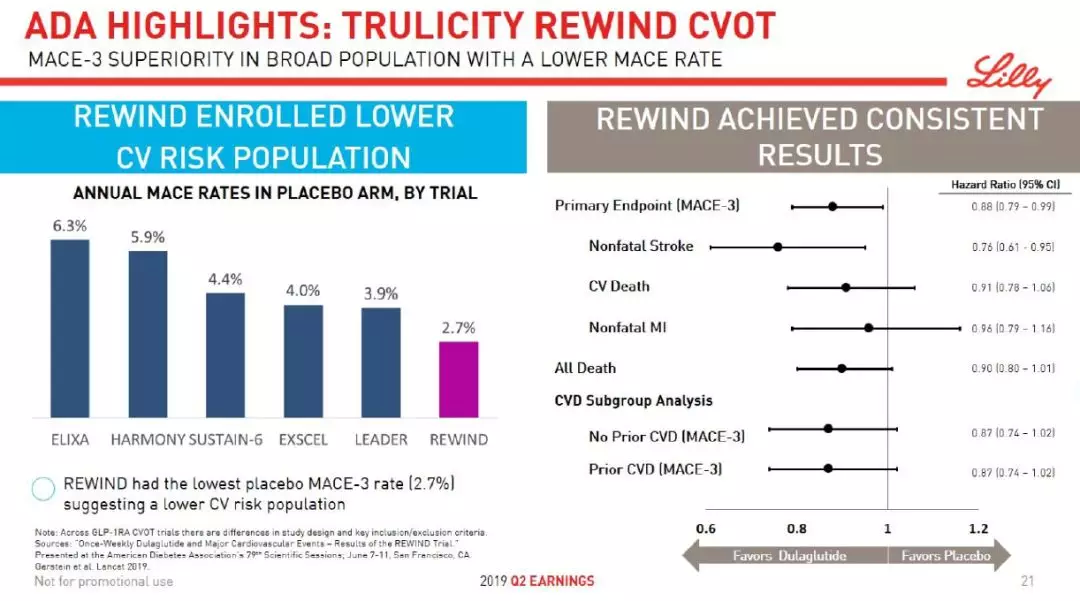
Trulicity是一款每周注射一次的GLP-1受体激动剂。在ADA大会上公布数据表明,它能够在广泛人群中显著降低主要不良心血管事件(MACE)的发生率。
图片来源:参考资料[3]
在今年下半年,礼来公司可能递交3项监管申请,其中包括从收购Loxo Oncology公司获得的RET抑制剂,它将用于治疗携带特定RET基因突变的NSCLC和甲状腺癌患者。另一项申请是在欧盟和日本扩展IL-17A抑制剂Taltz的使用范围,用于治疗放射性轴性脊柱关节炎。
![]()
图片来源:参考资料[3]
辉瑞(PFE.US)
![]()
辉瑞公司昨日发布的重磅消息是与迈兰(Mylan)公司达成协议,将专注于非专利品牌和仿制药业务的辉瑞普强(Upjohn)公司与迈兰公司合并。去年,辉瑞还与葛兰素史克(GSK)达成协议,合并消费者保健业务。这些举措,让辉瑞公司能够专注于创新疗法的开发。在今年第二季度,该公司开发的创新疗法Vyndaqel/Vyndamax获得FDA批准,治疗因为野生型或遗传性转甲状腺素蛋白介导的淀粉样变性引起的心肌病(ATTR-CM)。Vyndaqel/Vyndamax是“first-in-class” 转甲状腺素蛋白(TTR)稳定剂tafamidis的两种口服配方。今年5月,FDA还批准了辉瑞与德国默克(Merck KGaA)联合开发的PD-L1抗体Bavencio与Inlyta联用,一线治疗晚期肾细胞癌患者。辉瑞开发的三款生物类似药也获得了FDA的批准。
![]()
图片来源:参考资料[4]
在新药研发方面,辉瑞在开发肺炎疫苗、治疗罕见病、癌症以及炎症性疾病方面都取得了进展。该公司开发的JAK1抑制剂arocitinib在治疗特应性皮炎的3期试验患者中获得积极结果。该公司与礼来公司合作开发的创新止痛药tanezumab已经在多项3期临床试验中达到主要终点。辉瑞和礼来公司计划在今年第四季度,向FDA递交使用这款NGF单克隆抗体缓解骨性关节炎疼痛的新药申请。
![]()
图片来源:参考资料[4]
参考资料:
[1] Sanofi Q2 Results, Retrieved July 30, 2019, from https://www.sanofi.com/-/media/Project/One-Sanofi-Web/Websites/Global/Sanofi-COM/Home/common/docs/investors/Q2_2019_Presentation_Final_v2.pdf?la=en&hash=C5072CF2869CBAAB590388281A671BC8A7DD0F1C
[2] Fitusiran. Retrieved July 30, 2019, from https://www.alnylam.com/web/assets/Hemophilia-Overview-Fitusiran-Update.pdf
[3] Lilly Q2 Results. Retrieved July 30, 2019, from https://investor.lilly.com/static-files/abf8ef65-872e-46db-b81d-8cae4574d422
[4] Pfizer Second Quarter 2019 Earning Teleconference. Retrieved July 30, 2019, from https://s21.q4cdn.com/317678438/files/doc_financials/Quarterly/2019/q2/Q2-2019-Earnings-Charts-FINAL.pdf