本文来自微信公众号“药明康德”。
本周,葛兰素史克(GSK.US),罗氏(Roche),阿斯利康(AZN.US)等大型生物医药公司公布了2019上半年的运营报告。各家公司同时汇报了它们的研发布局和药物研发管线的最新信息。今日,药明康德内容团队将结合这些公司的运营报告和公开资料,与读者分享这些公司新药研发的最新动向。

GSK:扩展肿瘤学研发管线,加快技术革新步伐
GSK首席科学官Hal Barron博士上任以来,致力对GSK研发管线进行更新。在他的领导下,GSK的药物研发管线在过去12个月里出现了翻天覆地的变化,11项研发项目被终止,取而代之的是18项新的研发项目,其中四款在研新药已经进入或完成注册性研究。
GSK的肿瘤学药物管线扩展尤为迅速,在研疗法从8个扩展到17个,在未来18个月中可能有3款产品上市。这些在研疗法不但数目众多,而且代表着不同的作用机制。

图片来源:参考资料[1]
PARP抑制剂Zejula
GSK肿瘤学药物研发的一个主要方向是使用功能基因组学(functional genomics),根据“合成致死”原理探索新的基因与基因的相互作用,开发创新靶点、组合疗法,以及发现可能从已有疗法中获益的新患者群。这方面的一个范例就是PARP抑制剂Zejula。
这款从TESARO获得的PARP抑制剂曾经被认为只对携带生殖系BRCA基因突变(gBRCA)的患者有效,然而这些患者只占卵巢癌患者的15%。GSK认为携带同源重组通路上其它基因突变(HRD+)的卵巢癌患者可能从Zejula获益,并且启动了PRIMA临床试验验证这一假说。
近日公布的PRIMA试验结果证明,Zejula作为一线维持疗法,可以扩展到更广泛的患者群。GSK计划在今年年底之前递交监管申请。
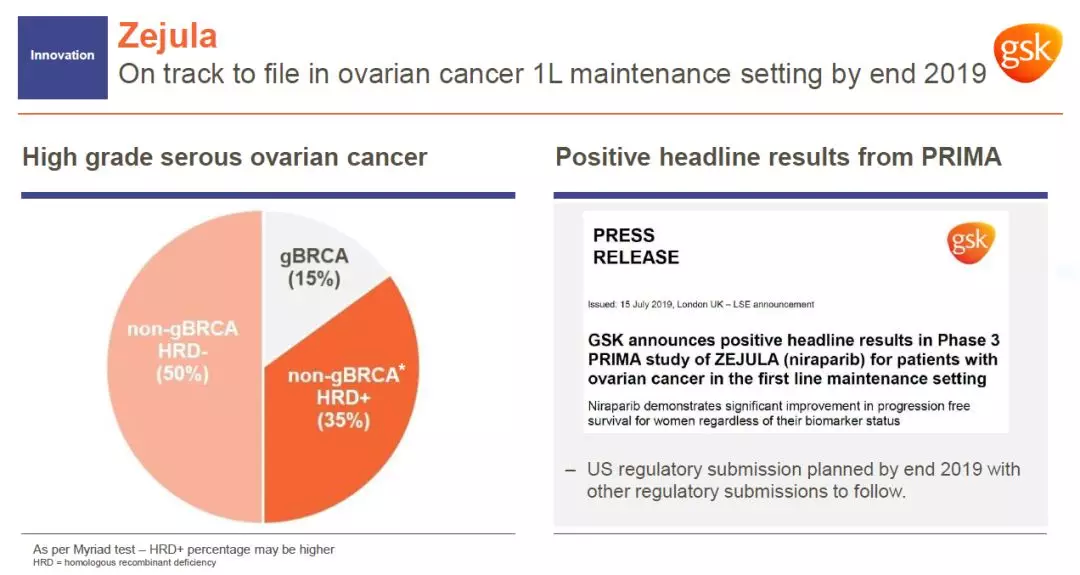
图片来源:参考资料[1]
除了这一进展以外,Zejula还在多项临床试验中与其它疗法联用,治疗不同类型的卵巢癌患者。最近的科学研究表明,PARP抑制剂可能通过抑制核糖体组装的机制对更多癌症类型起作用。如果这一机制在临床试验中获得验证,我们有望看到Zejula为更多癌症患者造福。
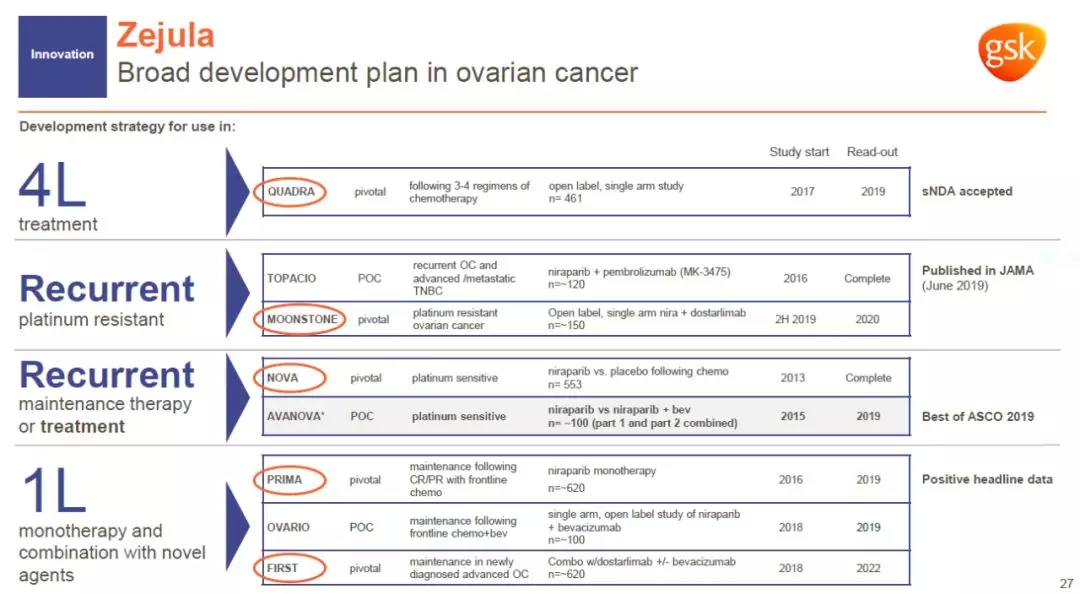
图片来源:参考资料[1]
抗体偶联药物belantamab mafodotin
Hal Barron博士介绍的另一款肿瘤学在研疗法是名为belantamab mafodotin的抗体偶联药物(ADC)。这是一款靶向B细胞成熟抗原(BCMA)的ADC。BCMA是治疗多发性骨髓瘤(MM)的热门靶点,GSK已经启动一项注册性3期临床试验(DREAMM-2),检验这款ADC作为3线或4线疗法,治疗复发/难治性MM患者的疗效。这一试验的数据将支持GSK在今年年底之前递交监管申请,有望明年为这些治疗选择非常有限的MM患者造福。
GSK同时计划开展多项3期临床试验,检验这款ADC作为2线和1线疗法,治疗MM患者的疗效。

图片来源:参考资料[1]
双特异性融合蛋白bintrafusp alfa(M7824)
GSK与德国默克(Merck KGaA)的合作为其研发管线带来了bintrafusp alfa。这是一款能够同时阻断TGF-β和PD-L1信号通路的“first-in-class”双功能融合蛋白。很多癌症患者对已有的PD-1/PD-L1抑制剂没有反应,bintrafusp alfa试图通过抑制TGF-β,降低肿瘤微环境的免疫抑制能力,提高PD-1/PD-L1抑制剂的疗效。
这款双特异性融合蛋白不但在二线治疗非小细胞肺癌方面表现出良好的疗效,而且二线治疗胆管癌的试验中达到20%的总缓解率。胆管癌患者目前没有有效的二线疗法。在与监管机构沟通之后,GSK将开展一项包含141名患者的注册性研究。
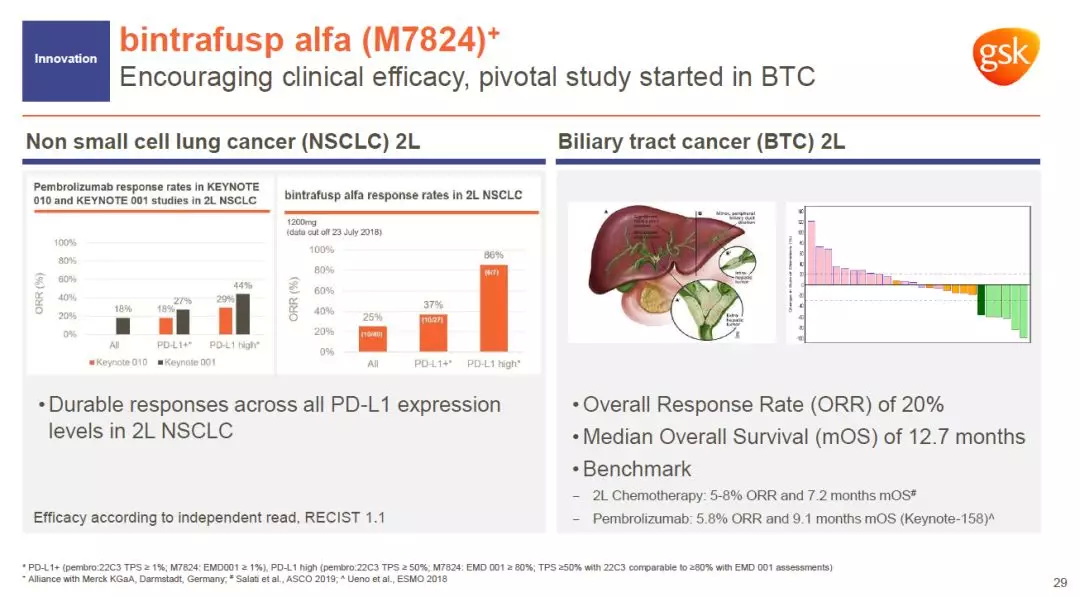
图片来源:参考资料[1]
抗PD-1单抗dostarlimab
Dostarlimab是GSK从TESARO获得的抗PD-1单克隆抗体。它目前在一项临床试验中作为单药疗法,治疗晚期实体瘤患者,其中包括复发型子宫内膜癌。初步结果表明,dostarlimab在微卫星不稳定(MSI)患者群中达到49%的总缓解率(ORR),在微卫星稳定(MSS)患者群中达到20%的ORR。这项关键性临床试验预计将在今年第三季度获得结果,支持该公司在第四季度递交新药申请。

图片来源:参考资料[1]
ICOS受体激动剂GSK’609
ICOS受体又名CD278,是一种T细胞共刺激受体。它在T细胞的增殖、生存和识别外来抗原功能方面有重要作用。GSK‘609是一款激动性ICOS受体单克隆抗体。它能够在激活ICOS受体的同时不导致细胞衰竭,从而可能帮助进一步激活T细胞的免疫反应,提高免疫检查点抑制剂的疗效。
目前,GSK‘609在多项临床试验中与不同的免疫检查点抑制剂联用,治疗不同癌症类型,其中包括与Keytruda联用治疗头颈癌。
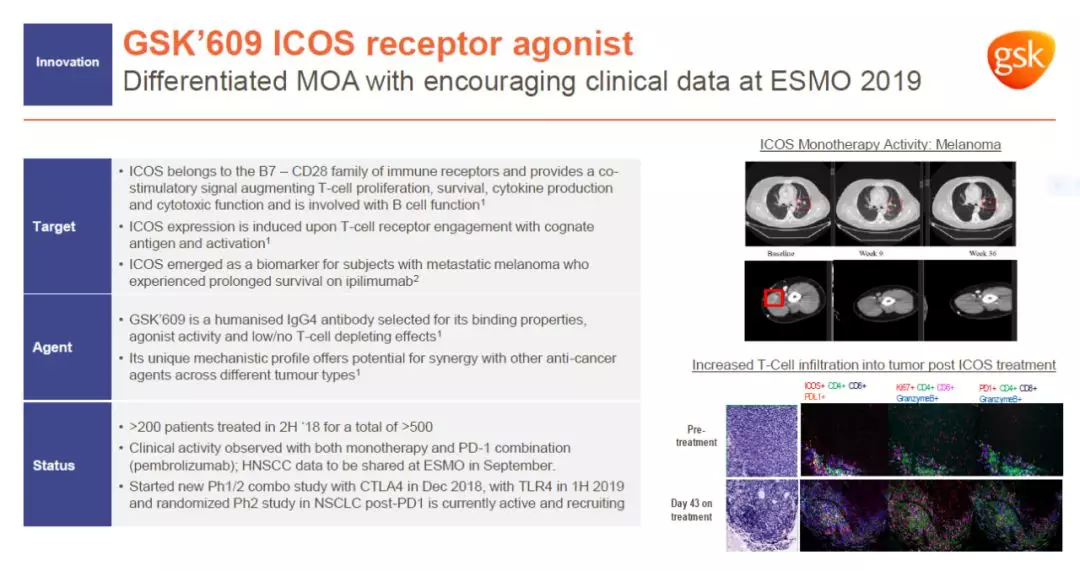
图片来源:参考资料[1]
加快技术革新的步伐
除了对药物研发管线进行更新以外,GSK还通过达成各种研发合作,加快了技术革新的步伐。GSK的愿景是基于人类遗传学和包括功能性基因组学、人工智能/机器学习,以及细胞疗法在内的尖端科技,为患者开发创新药物。
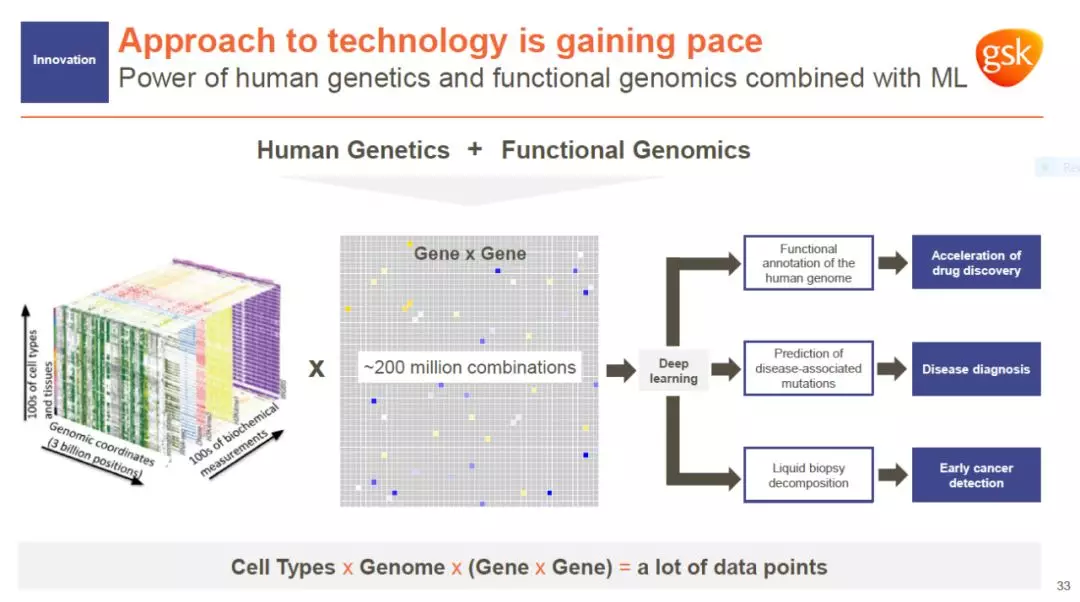
图片来源:参考资料[1]
在过去12个月中,GSK达成的合作项目彰显了该公司的技术开发方向。与23andMe的合作已经带来6个创新靶点,有望在2020年将第一款联合研发项目推入临床期开发。今年早些时候,GSK与CRISPR先驱Jennifer Doudna和Jonathan Weissman博士合作创建了基因组研究实验室(Laboratory for Genomics Research)。这一实验室将利用自动化和人工智能科技,大幅度加快CRISPR技术在药物筛选等方面的应用。
而GSK和Lyell公司的合作代表了GSK公司在改良CAR-T和TCR-T细胞疗法方面的研究方向。Lyell公司是一家致力于研究T细胞衰竭现象,开发细胞疗法的公司。GSK认为T细胞衰竭是限制CAR-T和TCR-T细胞疗法疗效的重要原因。

图片来源:参考资料[1]
展望2019年下半年,Hal Barron博士表示,GSK有望递交6项监管申请。
罗氏:进入全新疾病领域
罗氏(Roche)的创新ADC疗法Polivy(polatuzumab vedotin)在今年6月获得FDA的加速批准,治疗复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)成人患者。这是一款靶向CD79b抗原的ADC。在关键性随机2期临床试验中,Polivy能够显著降低患者死亡风险。目前,罗氏已经启动3期临床试验,检验Polivy一线治疗DLBCL的疗效。
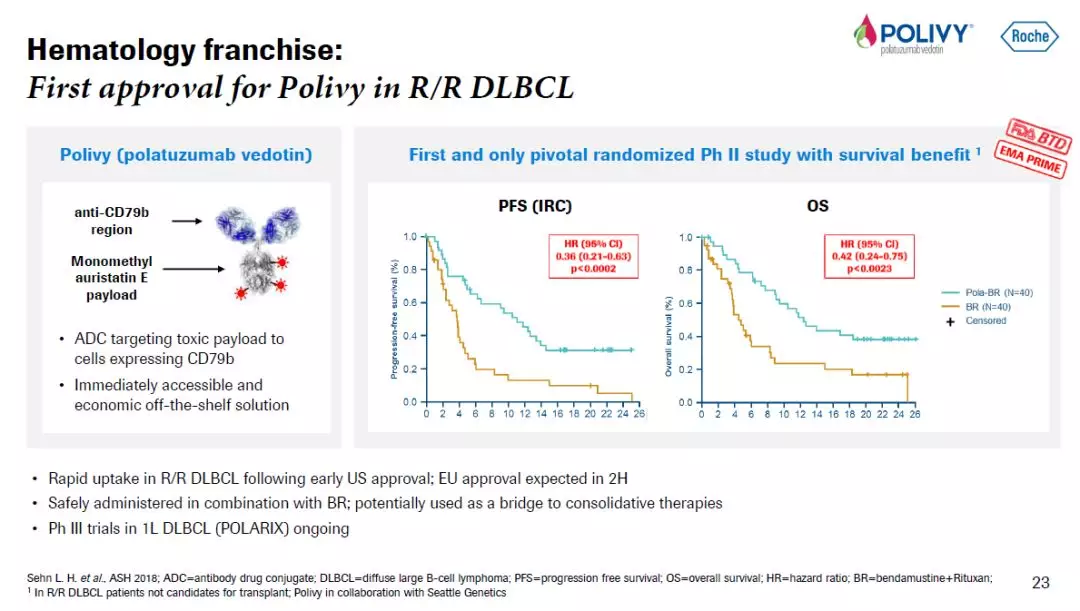
图片来源:参考资料[2]
罗氏的Gazyva与艾伯维(AbbVie)的Venclexta联用,获得FDA批准,一线治疗慢性淋巴性白血病(CLL)或小细胞淋巴瘤(SLL)患者。Gazyva是一款对抗体Fc片段进行糖基化改造(glycoengineered)的抗CD20抗体,它具有更好的清除外周和组织中B细胞的能力。近年来的科学研究显示,组织中存在的B细胞在狼疮性肾炎(lupus nephritis)中起到重要作用,它们需要被完全清除。目前狼疮性肾炎患者没有获批疗法,具有极大未竟需求。
Gazyva在治疗狼疮性肾炎患者的2期临床试验中已经达到主要和关键性次要临床终点。罗氏已经启动了3期临床试验,并且将在未来的科学会议上公布详细试验结果。
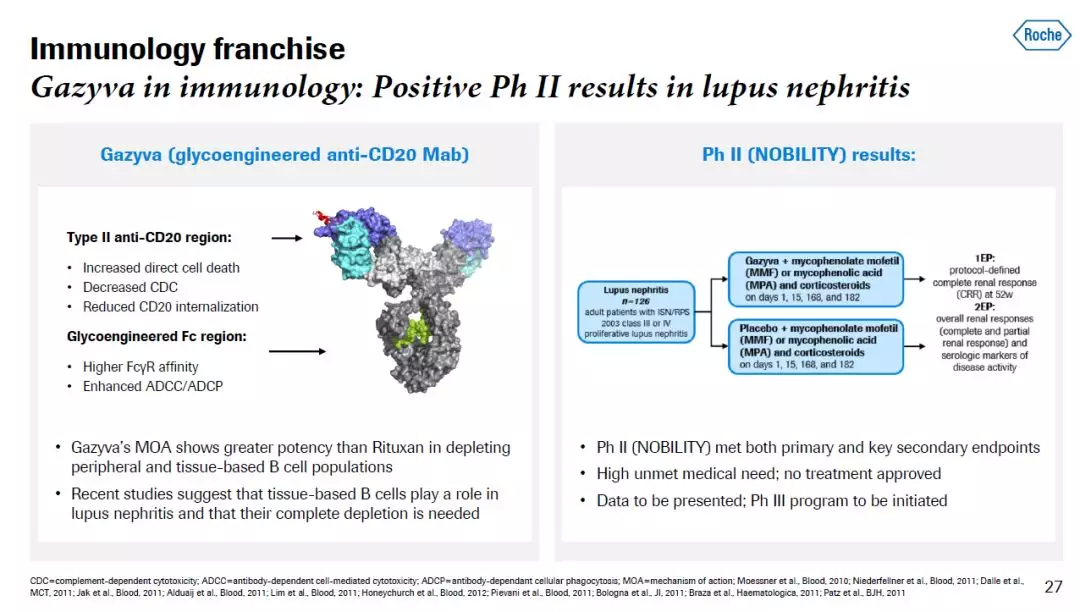
图片来源:参考资料[2]
在眼科领域,罗氏的faricimab是一款同时靶向VEGF-A和血管生成素-2(Ang-2)的双特异性抗体。这是第一款用于治疗眼科疾病的双特异性抗体。它在治疗湿性年龄相关性黄斑变性(nAMD)和糖尿病性黄斑水肿(DME)的2期临床试验中已经表现出良好的疗效。目前,检验faricimab治疗nAMD和DME的3期临床试验处于患者注册阶段。
同时,该公司在进行3期临床试验,检验称为PDS的新型给药系统治疗nAMD的效果。PDS是一种可以在局部麻醉情况下植入眼中的植入体,只有米粒大小。它可以持续释放一种特殊配方的ranibizumab,让患者只需要每6个月接受一次治疗。

图片来源:参考资料[2]
今年下半年,罗氏预计将递交治疗脊髓性肌萎缩症(SMA)的口服疗法risdiplam的新药申请。这款通过调节SMN2基因的mRNA剪接提高SMN蛋白水平的小分子药物,在临床试验中可以改善1型、2型和3型SMA患者的症状。该公司还计划递交satralizumab的新药申请,这款IL-6抗体在治疗视神经脊髓炎谱系障碍(NMOSD)的3期临床试验中已经达到3期主要终点,并且获得了美国FDA授予的突破性疗法认定。
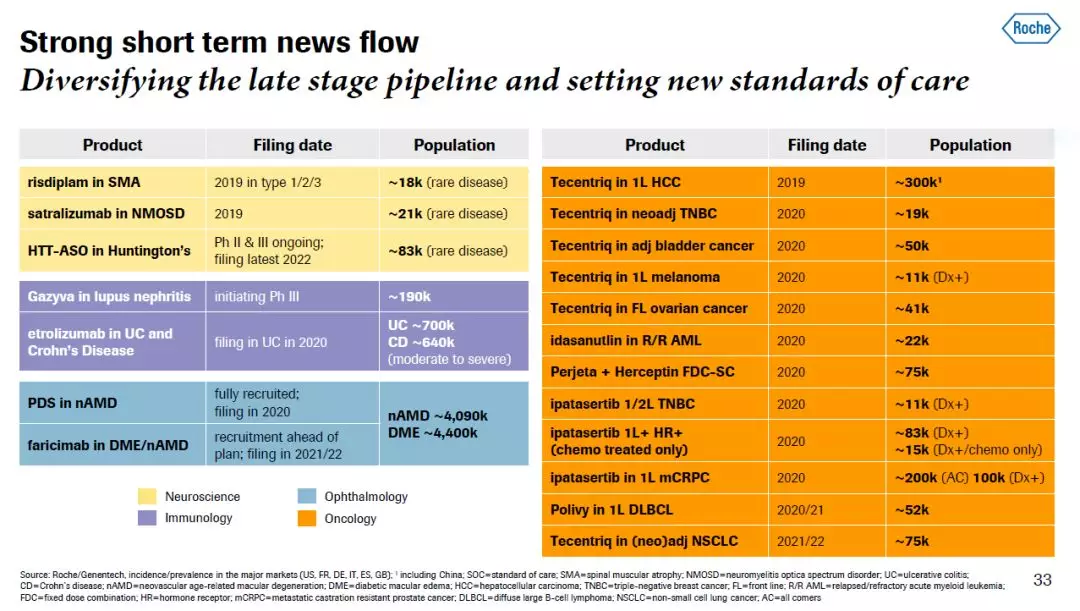
图片来源:参考资料[2]
狼疮性肾炎,SMA和NMOSD均为罗氏首次进入的疾病领域,我们期待这些创新疗法能够早日为这些疾病患者造福。
阿斯利康: 专注推动药物研发管线进展
阿斯利康在今年早些时候与第一三共(Daiichi Sankyo)达成研发协议,共同开发靶向HER2的创新ADC疗法。在第二季度财报的电话会议上,该公司首席执行官Pascal Soriot先生表示阿斯利康将聚焦于推动自身药物研发管线的进展。
在肿瘤学方面,推广PARP抑制剂Lynparza的应用范围是研发重点之一。在今年ASCO年会上公布的数据表明,Lynparza在治疗携带生殖系BRCA基因突变(gBRCAm)转移性胰腺癌患者,携带BRCA基因突变的卵巢癌患者,以及无法切除的非小细胞肺癌(NSCLC)患者方面均显示出可喜的疗效。
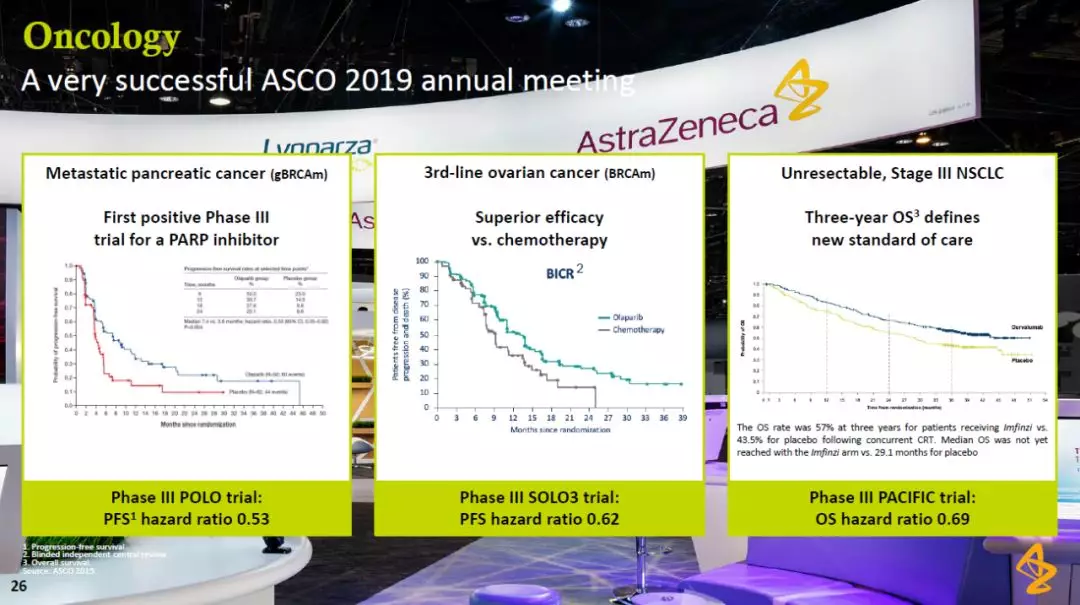
图片来源:参考资料[3]
在治疗血癌方面,BTK共价抑制剂Calquence在治疗复发/难治性(R/R)慢性淋巴性白血病(CLL)的3期临床试验中达到主要终点,将疾病进展风险降低近70%。阿斯利康计划在年底之前递交Calquence治疗CLL的监管申请。
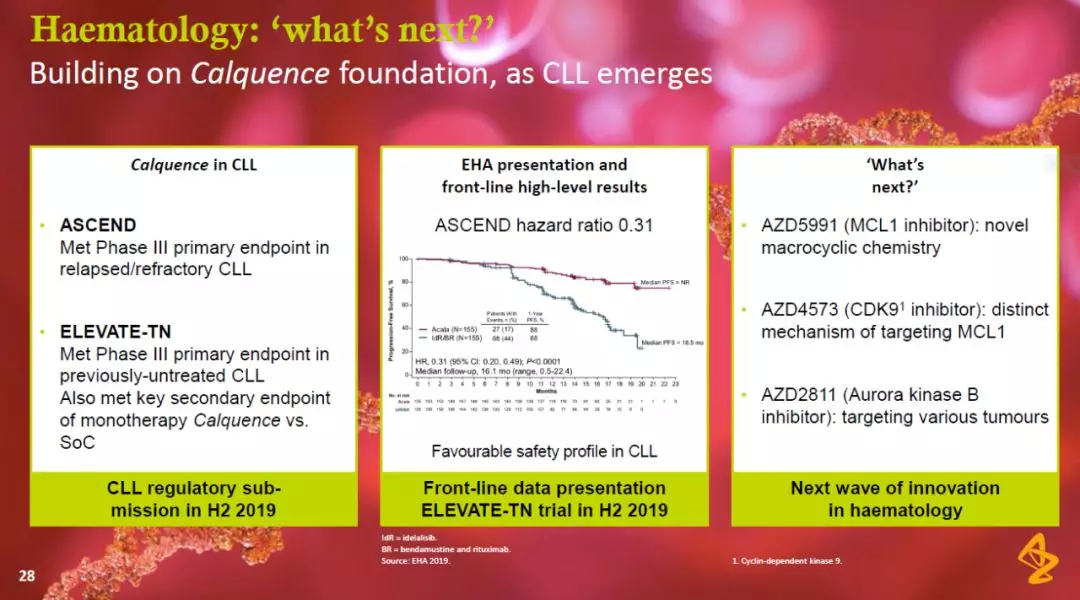
图片来源:参考资料[3]
预计在今年下半年,阿斯利康有6款产品可能获得监管批准(其中包括4款产品在中国获得监管批准),并且为8款产品递交监管申请。
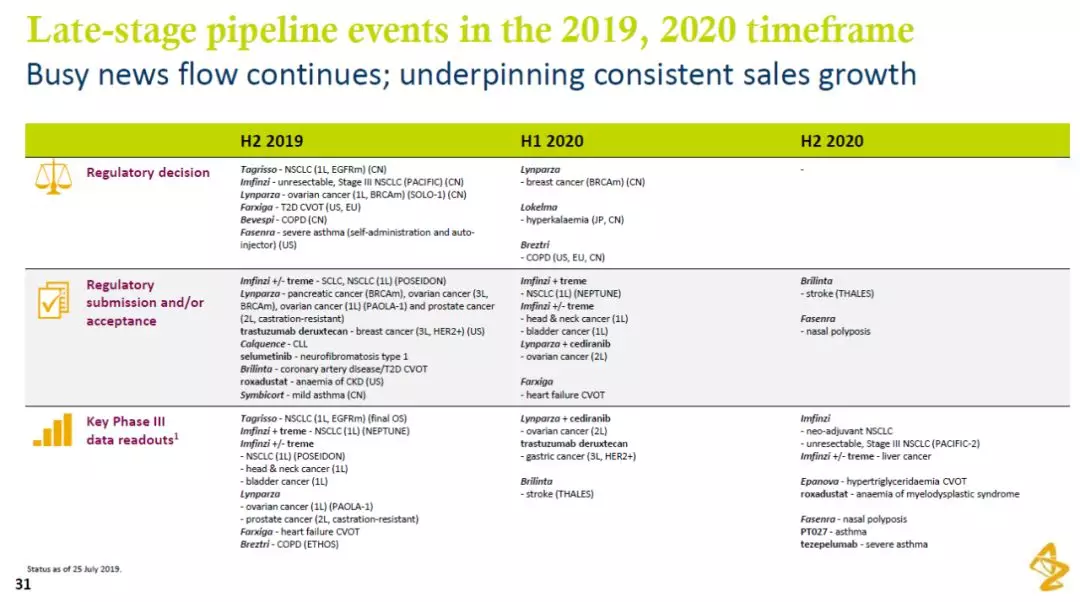
图片来源:参考资料[3]
参考资料:
[1] GSK Q2 2019 Results. Retrieved July 25, 2019, from https://www.gsk.com/media/5668/q2-2019-results-slides.pdf
[2] Roche HY 2019 Results. Retrieved July 25, 2019, from https://www.roche.com/dam/jcr:95d71790-eb20-436e-972d-044b1e979120/en/irp190725-a.pdf
[3] AstraZeneca H1 2019 Results. Retrieved July 25, 2019, from https://www.astrazeneca.com/content/dam/az/PDF/2019/h1-2019/H1_2019_Results_presentation.pdf
[4] https://www.gsk.com/media/5672/q2-2019-results-transcript.pdf





