在“带量采购”的袭击下,医药圈稍有风吹草动都能引发二级市场系列动荡,比如“4+7”从拟定、到正式出台的3个月内,港股整个医药板块已蒸发了近15个点,龙头股们的估值进一步遭遇锐减。
而“4+7”阴影还未消除,智通财经APP了解到,深圳人社局又搞出新动作。11月21日,深圳人社局发布了《2018年<深圳市重特大疾病补充医疗保险药品目录>增补遴选专家评审结果公示》。
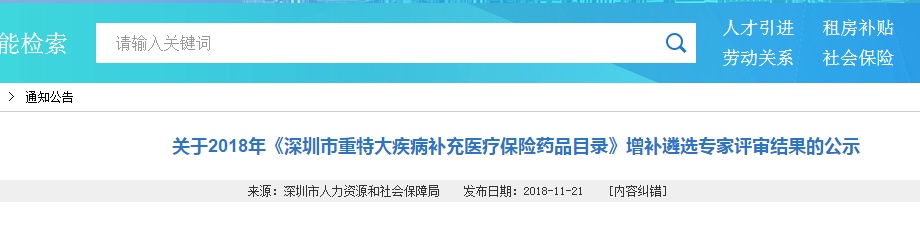
其中,K药(Keytruda)、阿来替尼、奥拉帕利等2018年刚刚上市的重磅抗癌药赫然在列。
从病患角度来说,这无疑是天大的好事,能避免“三年吃掉一套房”式的悲剧重演;可就药企,尤其是那些刚进军PD-1领域的“未盈利生物药企”则显然是“流年不利”,毕竟投入那么多,还没出来,别人就把医保市场给牢牢控住了。
深圳掀起地方抗癌药医保战
“4+7”刚出,抗癌药也掀起了地方医保战。
智通财经APP了解到,11月21日,深圳人社局发布了《2018年<深圳市重特大疾病补充医疗保险药品目录>增补遴选专家评审结果公示》。按其公布的品种,主要有10个,全是跨国药企的大品种,比如帕博利珠单抗注射液(Keytruda,俗称“K”药)、盐酸阿来替尼胶囊、奥拉帕利片、托珠单抗注射液等。
这也是K药首次进入城市级的医保目录,限用于经一线治疗失败的不可切除或转移性黑色素瘤的治疗,对病患意义可谓“重大”。
而按深圳重疾补充保险保障待遇,其在支付上享有较大的优惠:一是在同一社会医疗保险年度内,参保人住院时发生的医疗费用,累计超过1万元的,超出部分由承办机构平安(02318)保险深圳分公司支付70%,不设最高支付金额。
举个例子,如参保人因患肝癌在2017年7月1日至2018年6月30日在深圳市定点医院发生住院医疗费用48万元及经办理转诊手续在广州某医院发生住院医疗费用12万元,合计住院医疗费用60万元,其中社会医疗保险予以报销支付50万元,需由个人现金支付的10万元扣除社会医疗保险目录范围外费用2万元后,剩余8万元扣减1万元起付线后由平安保险支付70%,即4.9万元。
二是在同一社会医疗保险年度内,参保人因患重特大疾病在深圳市社会医疗保险定点医疗机构和定点零售药店购买目录内药品的费用,由平安保险支付70%,支付金额最高不超过15万元。
也就是说,参加重疾补充保险的参保人在购买《目录》药物是,可获得不超过15万的报销金额。再举个例子,如K药,其在中国零售价为17918元/100mg,仅为美国的54%,香港的68%,另外还具有“3+3”的良心赠药政策。
虽然赠药政策只给“低保户”,但如果满足医学条件和相应的经济条件,中国初级卫生保健基金会可为其援助最多不超过24个月用量的K药,按经济计算,目前K药在国内批准的适应症是恶性黑色素瘤,批准的剂量是2mg/kg,3周一次:对于50kg及以下患者,一年需要使用17次药物,费用约30万,3+3慈善赠药后只需负担9个周期的费用,费用约16万,再加上70%的报销比例的话,最终患者仅需要支付4.8万。
几十万的药费,只需要自掏腰包4.8万,你说这意义是否“重大”?
K药纳入地方医保带来“不安”
同样,深圳此举对药企也是意义“重大”,只不过其可能更多的一只无法言语的“压力”。
毕竟,其一方面面临政策挤压,毕竟医药市场非常讲究“先到先得”的玩法,一旦K药自降身份纳入地方医保体系,相信这块市场短期内很难有所改变,换句话说,基本就是默沙东(RMK.US)的天下;另一方还得随着应对国内强大的竞争与失败的风险。
智通财经APP看到的数据显示,目前国内共有30余家企业参与PD-1/PD-L1领域的竞争,其中4家已经提交上市申请(包含1家撤回申请)、18家正在进行临床、9家申报临床后等待批准。如恒瑞、百济神州(06160)、信达生物(01801)、药明康德、丽珠医药(01513)、即将上市的基石药业……
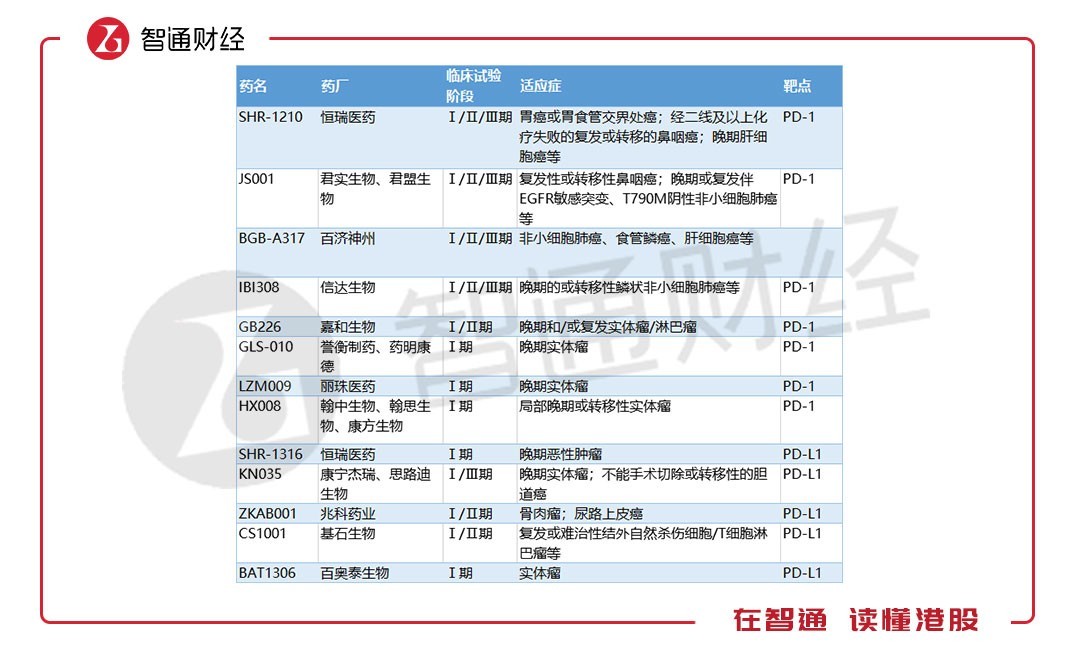
先说走在前列的百济神州。截至2018 年7 月5 日,tislelizumab 的临床试验已入组超过1500 位患者。迄今为止公布的初步数据表明,tislelizumab 于各种肿瘤类型中总体而言具有良好的耐受且表现出抗肿瘤活性。有望在2018 年在中国提交治疗霍奇金淋巴瘤的首次新药上市申请。
再到29日,该公司表示,收到tislelizumab(其研究性anti-PD-1抗体)治疗复发性或难治性经典霍奇金淋巴瘤中国患者的持续关键性临床2期试验的额外初步主要结果。
独立评估委员会的缓解评估显示,总缓解率为72.9%,其中50.0%为完全缓解。根据经更新数据独立评估委员会的缓解评估显示,总缓解率为85.7%,其中61.4%为完全缓解。两组数据的中位缓解持续时间均未达到。
再说收入为零的基石药业,他的是个全长、全人源IgG4PD-L1单克隆抗体,已在第III阶段非小细胞肺癌患者中(作为单一疗法)启动III期试验。计划分别于2018年底前、2019年上半年及2019年上半年在中国启动CS1001(PD-L1抗体)联合标准护理疗法用于治疗IV期非小细胞肺癌、胃癌及HCC患者的III期试验。
时间表虽已给出,但从纯上市速度上来讲,可能抵不过百济神州。
最后简单说说A股的恒瑞。国内的I期临床试验:有效率31.0%,疾病控制率为46.5%,未见完全缓解的患者。18位患者达到部分缓解,包括: 10位食管癌、3位胃癌、1位肺癌,1位鼻咽癌、1位肝癌、1位结直肠癌、1位膀胱癌。
而国外的I期临床试验:控制率43%。2015年9月,恒瑞公司以7.95亿美元的价格将自己的PD-1抗体在海外市场的开发和销售权益,出售给了Incyte公司。Inycte公司就在欧美等国开始了I期临床试验,试验的结果在欧洲肿瘤学年会上正式公布。入组的病人也非常有趣:子宫内膜癌、胸腺癌、胆道系统肿瘤以及原发灶不明的肿瘤,一共入组了9名患者,有3名患者疾病稳定,疾病控制率为33%。
总得来说,就算PD-1(PD-L1)市场庞大,但参考同一靶点最先上市的3家就能让市场饱和,后来者往往都是“赔钱,凑热闹”的经济规律,以及上述国产药企离真正上市还有很长一段路要走,所以,K药抢占地方医保市场对其真的算不上好消息。(田宇轩/文)





