CDH17 ADC
CDH17是钙粘蛋白超家族的成员,钙粘蛋白超家族是一组钙依赖性细胞粘附分子,对器官发育、组织完整性和癌症进展至关重要。
钙粘蛋白包含细胞外结构域、跨膜结构域和细胞内结构域,CDH17结构不同于经典钙粘蛋白,包括EC1到EC7七个cadherin重复序列和18-20个氨基酸的胞内结构域(图1)[1]。
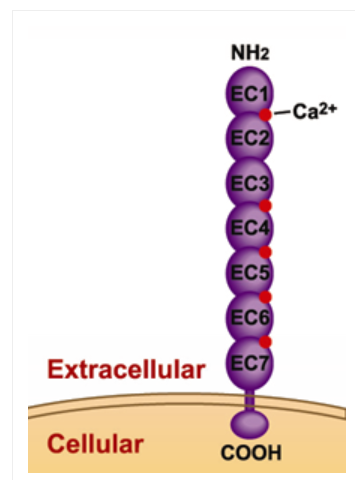
图1. CDH17结构
在正常组织中,CDH17高度局限于侧膜,隐藏在无法接近的肠道紧密连接处。相比之下,它在50%至90%的胃肠道癌症中过表达和重新分布,导致其暴露于癌细胞表面,因此变得更容易获得。这一独特功能使 CDH17 成为基于抗体的治疗的有前途的靶点。
今年AACR会议上,多家公司报道了其CDH17药物研发进展,包括维立志博的LBL-054、华东医药的HDM2017、Tavotek Biotherapeutics的TAVO307、宜联生物的YL127、SOTIO Biotech的SOT109、博奥信生物的BSI-721、橙帆医药的VBC108、礼新医药的LM-350、先声药业的SCR-A008等。
1.1 LBL-054
LBL-054是由南京维立志博生物开发的靶向CDH17 ADC药物,由人源化CDH17 IgG1 单克隆抗体与他们专有的接头-有效载荷平台偶联而成。
今年AACR会议上,维立志博报道了LBL-054在临床前异种移植模型中表现出抗肿瘤功效(图2)[2]。
研究结果显示:LBL-054表现出适当的亲和力和快速的内化。在CDH17阳性癌细胞的杀伤试验中,LBL-054比LBL-054-Dxd偶联物更有效,而LBL-054 比LBL-054-Dxd偶联物更不容易杀死CDH17阴性细胞。而且,LBL-054表现出比LBL-054-Dxd偶联物更强的旁观者效应。
LBL-054在血浆稳定性试验中高度稳定。在异种移植模型中,诱导肿瘤消退的单剂量LBL-054比LBL-054-Dxd偶联物更有效,并且比LBL-054-Dxd偶联物的PK更好。
总之,通过与具有可切割/亲水接头的高效/旁观者/非pgp底物TOP1i有效载荷exatecan偶联,靶向CDH17的LBL-054在血浆中表现出高稳定性、强大的抗肿瘤活性和良好的异种移植模型中的良好耐受性,支持LBL-054用于CDH17表达肿瘤患者的临床开发。

图2. LBL-054的AACR信息
1.2 HDM2017
HDM2017是由华东医药自主研发的靶向CDH17的ADC,由靶向CDH17人单克隆抗体与CPT衍生物有效载荷化学偶联而得,正在进行IND支持研究。
今年AACR会议上,华东医药公布了HDM2017的体外和体内临床前研究结果:HDM2017与CRC和GC细胞表现出优异的细胞结合活性,EC50范围为0.1-1.0 nM(图3)[3]。
此外,HDM2017表现出强大的靶标介导的内化活性,实现了43-75%的内化效率。HDM2017在一系列表达CDH17的肿瘤细胞系中显示出有效的体外抗肿瘤活性。HDM2017处理导致CDH17人CRC(71~97% TGI)和GC(71~90% TGI)异种移植模型中的肿瘤生长显着抑制,表明HDM2017有可能为胃肠道癌症患者提供临床益处。

图3. HDM2017的AACR信息
02MSLN ADC
MSLN(Mesothelin,间皮素)是一种细胞表面分子,以成熟形式表达为通过糖基磷脂酰肌醇键固定在细胞膜上的40 kDa蛋白。
MSLN结构主要由细胞外结构域,包含一个信号肽、一个成熟肽和一个跨膜锚定区以及跨膜锚定区组成(图4)[4]。
其中成熟肽部分在细胞表面表达,是抗体药物和免疫疗法的主要靶点,MSLN通过跨膜锚定区固定在细胞膜上,使其能够稳定地表达在细胞表面。
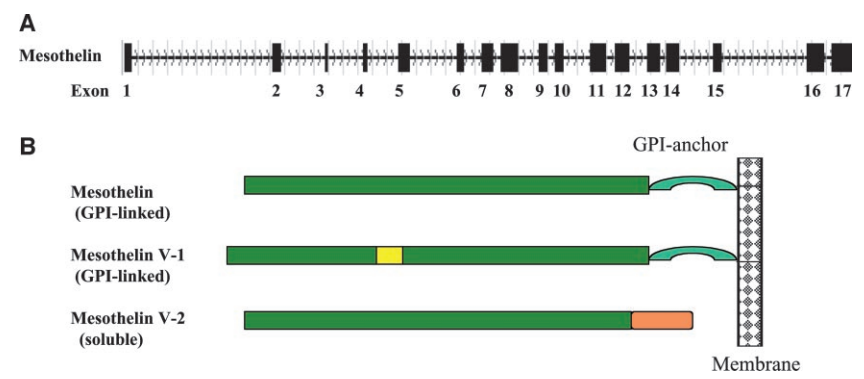
图4. 间皮素基因及其编码的蛋白质的示意图
MSLN在体内与很多信号通路相关,如通过与可溶性或细胞表面MSLN相互作用,MSLN可以触发 Akt、ERK1/2 和 JNK 信号通路。
Akt和ERK1/2信号转导的下游作用包括抑制Bim、Bad和Bax,然后抑制细胞凋亡和/或刺激 Bcl-xl/Bcl-2导致细胞存活。Akt、ERK1/2和JNK通路显示会增加基质金属蛋白酶7(MMP-7)的表达,从而导致细胞迁移和侵袭速率。MMP-7 通路也可以通过SGK3/FOXO3和p38通路。SGK3/FOXO3 信号转导也被证明会导致DKK1的下调和表达,从而增加细胞迁移(图5)[5]。
MSLN的异常与很多疾病相关,在许多实体瘤中过表达,包括卵巢癌、胰腺癌、子宫内膜癌、肺癌和结直肠癌等。
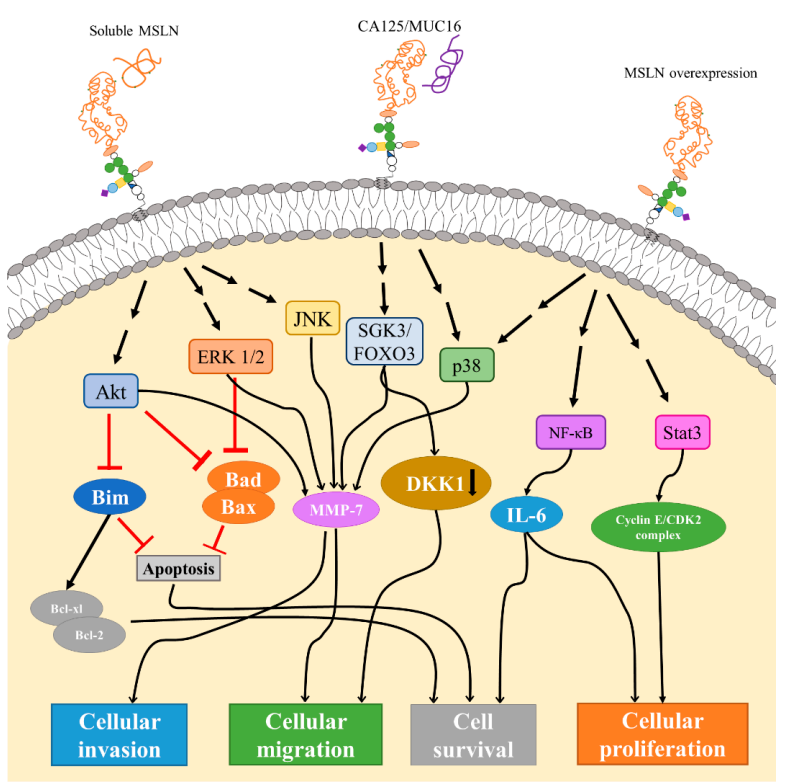
图5. MSLN介导的相关信号通路
自发现以来,MSLN一直是各种方式的抗肿瘤疗法开发的目标,有很多不同在研药物类型,包括抗体、CAR-T 和多种ADC药物等。
2.1 PF-08052666
PF-08052666是由辉瑞与和铂医药合作开发的一种靶向MSLN的ADC,通过可裂解的甲磺酰基嘧啶三肽连接子将抗MSLN单克隆抗体与新型拓扑异构酶1抑制剂SGD-12280连接而得。
PF-08052666 旨在通过新型抗体、差异化有效载荷和更高的药物抗体比 (DAR)来克服上一代抗MSLN ADC的缺点(图6)[6]。
在体外,PF-08052666通过向MSLN阳性细胞递送有效载荷来驱动直接细胞毒性,旁观者对共培养的MSLN阴性细胞进行旁观者杀伤活性,并在生理相关浓度的可溶性MSLN存在下保持细胞毒性。
在体内,PF-08052666 在各种肿瘤类型(包括卵巢癌、肺癌和结直肠癌)的细胞系和患者来源的异种移植模型中优于基于DM4的抗MSLN基准ADC。这些数据支持PF-08052666正在进行的晚期实体瘤患者1期临床试验,该试验目前正在招募(NCT06466187)。
图6. PF-08052666的AACR信息
2.2 RC88
RC88是由荣昌生物自主研发的新型靶向MSLN的 ADC药物,具有first-in-class潜力,荣昌生物采用自主研发的创新桥接技术,将MSLN靶向抗体、可裂解连接子以及小分子细胞毒素(MMAE)连接而得,通过靶向结合MSLN阳性的肿瘤细胞,RC88能够介导抗体的内吞,将细胞毒素定向传递给癌细胞,实现较好的肿瘤杀灭效果。
荣昌生物的ADC平台具有下述主要功能:ADC连接子及载荷优化的筛选平台;专有桥接(Thiel-bridge)偶联技术;连接子、载荷及偶联工艺开发; 连接子、载荷及连接载荷的GMP合成;ADC的DS和DP的GMP生产。
RC88已获得美国FDA授予的快速通道资格,用于治疗铂耐药复发性上皮性卵巢癌、输卵管癌和原发性腹膜癌,目前正处于晚期实体瘤的I/II期试验中,无论是单药治疗(NCT04175847、NCT06173037)还是联合治疗(NCT05804526)。
今年的AACR会议,荣昌生物揭示了RC88的独特特性,RC88 对不同的 MSLN区域具有独特的结合动力学,通过严格的方法具有占主导地位的N端结合位点(图7)[7]。
RC88与其他抗MSLN抗体相比,对MSLN阳性癌细胞的结合效果更好,并且在sMSLN干扰下仍保持有效性。与其他抗体相比,它与C端MSLN片段的结合更强,进一步强调了其在肿瘤细胞中的靶向潜力。
鉴于其独特的结合特性,RC88可能为治疗MSLN阳性癌症带来增强的临床益处,即使肿瘤细胞中存在sMSLN和各种截短形式的MSLN。因此,RC88在临床研究中可能比其他MSLN ADC具有更大的临床益处。

图7. RC88的AACR信息
03PSMA ADC
PSMA(前列腺特异性膜抗原)是一种II型跨膜糖蛋白,包含跨膜结构域、细胞外结构域以及酶活性区域,PSMA具有N-乙酰基-α-氨基己糖苷酶(GluN)的酶活性,能够水解N-乙酰氨基己糖苷,这种酶活性在某些生理和病理过程中发挥作用(图8)。
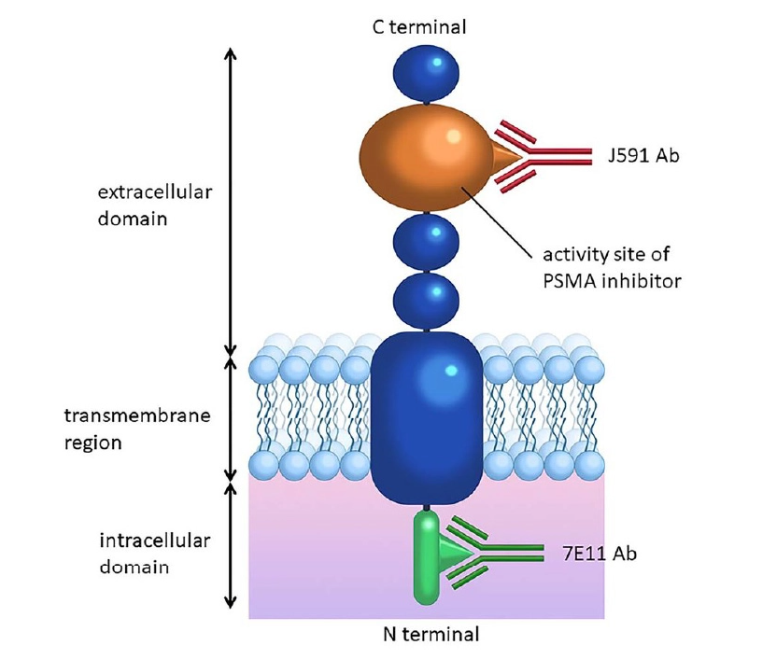
<span mpa-">PSMA在绝大多数前列腺癌(PCa)细胞中高表达(正常值的100-1000倍),包括晚期疾病患者、去势抵抗性疾病患者和低分化疾病患者。此外,PSMA对前列腺癌细胞的内化率很高。
由于其在前列腺癌中的普遍存在以及上述特征,PSMA已成为前列腺癌患者影像学模式和治疗方法研究的有吸引力的目标,是一个成熟的靶向前列腺癌的诊断和治疗领域,目前开发的靶向PSMA的治疗方法有放射性配体治疗、ADC药物和CAR-T细胞疗法等。
3.1 GenSci143
B7-H3和PSMA都是在PCa中表现出高水平表达的肿瘤相关抗原,用单一药物双重靶向它们代表了治疗转移性去势抵抗性前列腺癌(mCRPC)的一种有前途的治疗方法。
GenSci143是由金赛药业开发的一种高度差异化的B7-H3 x PSMA双抗ADC,由针对B7-H3和PSMA的双特异性抗体、高度稳定但可切割的连接子和有效的拓扑异构酶1抑制剂有效载荷组成。GenSci143作为新型靶向癌症疗法的潜力目前正在临床前研究中进行评估。
今年AACR会议上,金赛药业带来了GenSci143最新进展:GenSci143在表达B7-H3或PSMA或两者TAA的肿瘤细胞中显示出很强的体外结合、内化和细胞毒性(图9)[8]。
在体内,GenSci143在不同B7-H3和PSMA表达水平上有效诱导肿瘤消退,并显示出优于DS-7300和ARX517类似物的抗肿瘤功效。
此外,GenSci143的体外血浆稳定性比DS-7300好得多。食蟹猴以10 mg/kg 静脉注射后,GenSci143表现出良好的药代动力学特征,在任何时间检查的血清游离有效载荷浓度均低于1.0 ng/mL。在食蟹猴的非GLP重复剂量毒性试点研究中,GenSci143的耐受性良好,根据 PK-PD 建模和模拟,其治疗指数明显高于 DS-7300。
这些结果表明,GenSci143有可能成为mCRPC患者的有效治疗选择,并支持其在IND支持研究中进一步评估。

图9. GenSci143的AACR信息
3.2 SDV2102
SDV2102是由Syndivia开发的一种靶向PSMA的ADC药物,采用GeminiMab™技术将新型抗PSMA抗体D1与微管蛋白抑制剂MMAE偶联而得,主要用于治疗转移性去势抵抗性前列腺癌(mCRPC)
值得注意的是,SDV2102 的药物抗体比(DAR)为 1,允许更高的剂量和更高的疗效,而不会成比例地增加全身毒性,从而提高治疗指数。
今年AACR会议,Syndivia带来了SDV2102 的临床前评价结果:在C4-2 细胞来源的异种移植物(CDX)模型中,当以等剂量的 MMAE 给药时,SDV2102 显示出比使用通用J591抗体或D10抗体构建的经典DAR4 ADC具有显著更高的抗肿瘤功效(图10)[9]。
此外,SDV2102在具有低至中等PSMA表达水平的患者来源异种移植物 (PDX)模型中显示出有效的活性。
大鼠药代动力学研究表明,SDV2102 具有良好的特征,与未偶联的 D10 抗体非常相似,表明在循环中保持了抗体样特征。C4-2 模型中的剂量反应研究确定了2.5 mg/kg的最小有效剂量。
对非人灵长类动物的毒理学研究表明,在高达24 mg/kg 的剂量下没有重大毒性,未达到最大耐受剂量(MTD),表明治疗窗口很宽。SDV2102 的治疗指数为 38,具有相当大的安全边际。这些临床前结果支持 SDV2102 作为治疗 mCRPC的有前途的治疗候选药物进入临床试验。

图10. SDV2102的AACR信息
CEACAM5(通常称为CEA)是癌胚抗原相关细胞黏附分子(CEACAM)家族的成员之一。CEACAM家族包含12个成员,其中CEACAM5是最早被发现并广泛研究的成员(图11)[10]。
CEACAM5通过糖基磷脂酰肌醇(GPI)与细胞膜结合,包含7个免疫球蛋白样结构域,一个可变(IgV)样结构域(N结构域),以及三个重复单元,包括六个IgC样结构域(A1-B3)
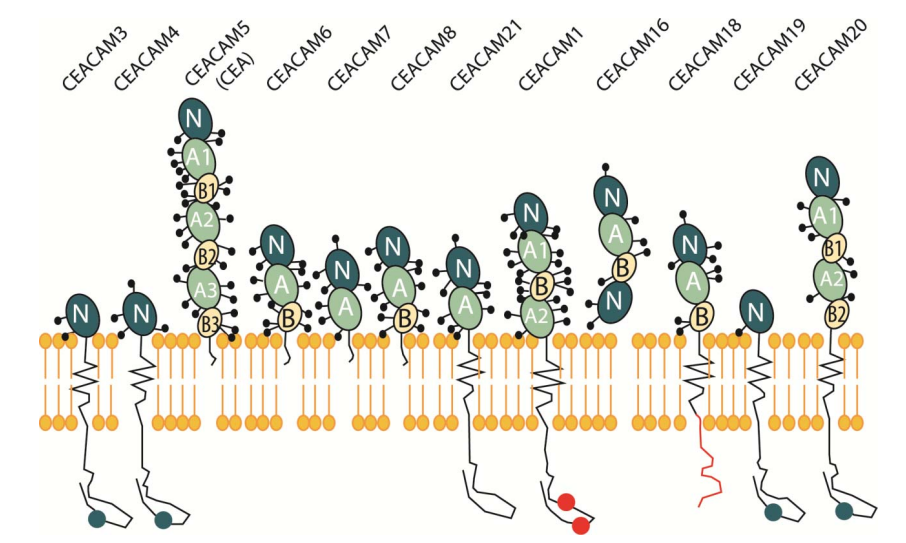
图11. CEACAM家族成员结构
CEACAM5在多种上皮肿瘤中高表达,包括结肠癌、胃癌、胰腺癌、卵巢癌和肺癌,靶向CEACAM5的治疗策略正在不断开发中,包括ADC药物、单域抗体药物偶联物(UdADC)、双特异性抗体以及CAR-T细胞疗法等。
4.1 BG-C47
BG-C477是由百济神州开发的一款靶向CEACAM5(CEA)的ADC药物,由CEACAM5特异性抗体通过可切割接头与Top1i有效载荷偶联(药物抗体比 = 8)组成,主要用于治疗晚期实体瘤,特别是肺癌和胃肠道肿瘤。
今年AACR会议,百济报道了BG-C477的研发进展。
与抗CEA DM4 ADC相比,BG-C477与表达CEA的MKN45细胞具有特异性结合和更强的内化活性。BG-C477在不同CEA表达水平的细胞系中表现出稳健且CEA依赖性的细胞毒性。
在与CEA阳性MKN45和阴性HCT116细胞混合的共培养杀伤试验中观察到BG-C477的有效旁观者效应,表明具有治疗异质性 CEA 表达的肿瘤的潜力。在动物研究中,BG-C477在多个表达CEA的CDX 和PDX模型中显示出有效和剂量相关的单药疗效。此外,BG-C477在GC和CRC PDX模型中表现出优异的抗肿瘤功效,而抗CEA DM4 ADC无效。
综上所述,BG-C477 是一种很有前途的CEA靶向ADC,在多种类型的肿瘤中具有很强的抗肿瘤活性。评估 BG-C477 的安全性、耐受性、药代动力学、药效学和初步抗肿瘤活性的人体研究正在进行中(NCT06596473)[11]。
图12. BG-C477的AACR信息
本文转发自微信公众号“新康界”,文章作者为BiG生物创新社;智通财经编辑:文文。