智通财经APP获悉,9月20日,据国家药监局(CED)官网显示,信达生物(01801)递交的IBI363临床试验申请获默示许可,联用贝伐珠单抗或仑伐替尼或呋喹替尼或/和化疗用于晚期肿瘤(受理号:CXSL2300471)。据悉,IBI363 是由信达生物自主研发的潜在同类首创(First-in-Class)新药,有效成分为 PD-1/IL-2 双特异性抗体融合蛋白。今年8月,信达生物宣布,IBI363的部分早期临床前核心机制研究结果发表在 Nature Cancer 期刊上。
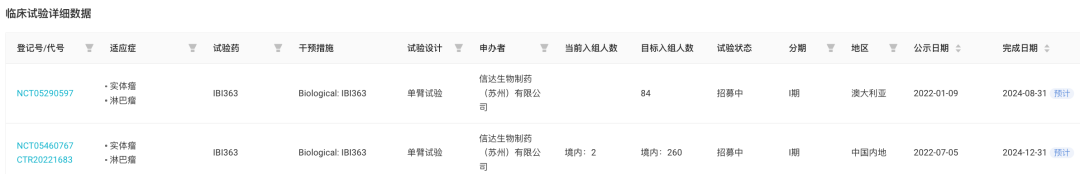
IBI363临床试验(数据来源:Insight数据库)






