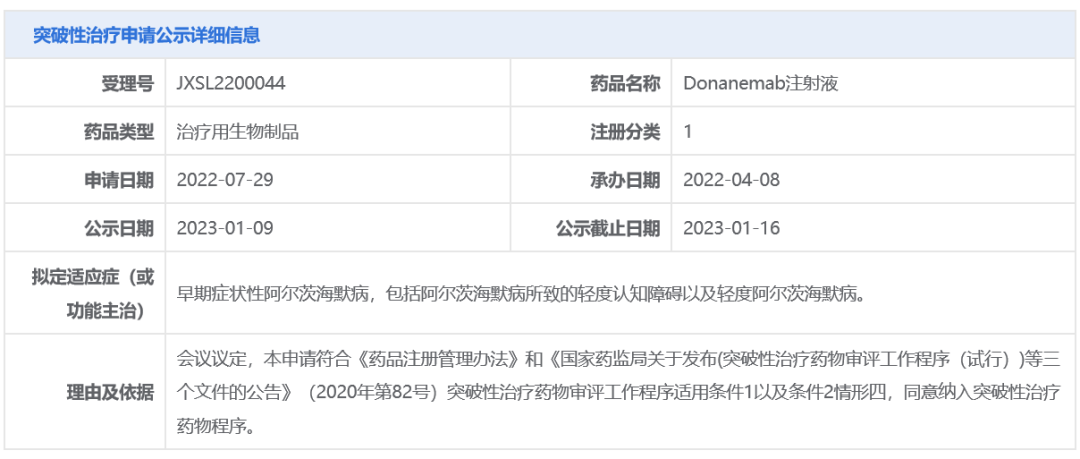
智通财经APP获悉,1月9日,中国国家药品监督管理局药品审评中心(CDE)官网最新公示,礼来公司(LLY.US)(Eli Lilly and Company)申报的1类新药donanemab注射液拟纳入突破性治疗品种,拟用于治疗早期症状性阿尔茨海默病,包括阿尔茨海默病所致的轻度认知障碍以及轻度阿尔茨海默病。公开资料显示,donanemab靶向被称之为N3pG的β淀粉样蛋白斑块,已在美国递交生物制品许可申请(BLA)并被FDA授予优先审评资格。
据悉,Donanemab是一款与β淀粉样蛋白亚型N3pG结合的单克隆抗体。它能够与阿尔茨海默病患者大脑中淀粉样蛋白沉积中的β淀粉样蛋白结合,从而促进患者大脑中淀粉样蛋白沉积的清除。此前,donanemab已经被FDA授予突破性疗法认定。2022年8月,FDA接受donanemab的生物制品上市许可申请,并授予其优先审评资格用于加速批准治疗早期阿尔茨海默病。
根据礼来早先公布的生物标志物研究结果,donanemab不但导致淀粉样蛋白沉积的快速清除,而且显著降低患者血浆中P-tau217的水平。这是礼来开发的一个在研血液生物标志物,与淀粉样蛋白、tau蛋白病理以及阿尔茨海默病的诊断相关。此外,donanemab还能够降低与大脑星形胶质细胞增生相关的炎症生物标志物GFAP的水平。这些证据表明该药能降低与阿尔茨海默病相关的多种病理过程。
在2022年年底召开的阿尔茨海默病临床试验大会上,礼来公布了donanemab在一项3期临床试验中的积极数据。在治疗6个月后,与基线相比,donanemab将早期阿尔茨海默病患者大脑中的淀粉样蛋白斑块水平降低65.2%,而活性对照组这一数值为17.0%。这一数据显示donanemab能够在治疗早期阶段迅速有效地改变阿尔茨海默病的生物学。
此前在医学杂志上发表的2期临床试验结果显示,donanemab能够缓解早期阿尔茨海默病患者的认知和日常生活能力的衰退速度。同时,正电子扫描(PET)成像显示,donanemab能够迅速清除患者大脑中的淀粉样蛋白沉积。在接受治疗6个月后,40%患者的PET检测呈阴性,意味着他们大脑中淀粉样蛋白沉积的水平和健康人没有显著区别。
根据中国药物临床试验登记与信息公示平台,礼来公司已于2022年9月在中国启动一项国际多中心(含中国)、随机、双盲、安慰剂对照、3期研究,旨在评估donanemab在存在脑tau蛋白病理的早期症状性阿尔茨海默病(包括阿尔茨海默病所致的轻度认知障碍以及轻度阿尔茨海默病)受试者中的安全性和有效性。该研究中国部分由首都医科大学宣武医院贾建平主任医师担任主要研究者,拟在中国近50家研究中心开展,目标入组人数为中国400人。






