从去年6月提交新药上市申请到今年3月被国家药监局纳入突破性治疗品种,作为全球范围内少数的治疗慢性髓性白血病(CML)耐药的重磅药物以及中国第一个三代格列卫,亚盛医药-B(06855)的核心候选产品奥雷巴替尼俨然已处在上市倒计时阶段。
如今,在奥雷巴替尼即将上市的关键时刻,亚盛医药再次携这款重磅品种亮相美国血液学会(ASH)年会,向全球血液学界公布其最前沿的研发进展,这已是继2018年之后,奥雷巴替尼第四次在ASH年会亮相,其间还于2019年获得ASH“最佳研究”提名。除奥雷巴替尼外,亚盛医药还向全球学界带来了其在细胞凋亡管线研发中两大关键产品的最新研发成果。
智通财经APP了解到,11月5日,亚盛医药宣布,公司共有三个在研新药(奥雷巴替尼、APG-2575、APG-1252)的六项研究进展入选第63届美国血液学会(American Society of Hematology,ASH)年会口头报告和壁报展示。
其中,公司在研原创1类新药奥雷巴替尼(Olverembatinib,HQP1351,曾用名耐克替尼、奥瑞巴替尼)共有三项临床进展入选第63届美国血液学会(American Society of Hematology,ASH)年会壁报展示及一项获口头报告。北京大学人民医院血液科黄晓军教授和江倩教授是该口头报告相关研究的主要研究者,江倩教授将在会议期间作此报告。这是奥雷巴替尼的临床进展连续第四年入选ASH年会口头报告,充分显示了国际血液学界对其疗效和安全性的认可。
此外,公司细胞凋亡品种在研原创1类新药Bcl-2选择性抑制剂Lisaftoclax(APG-2575)和Bcl-2/Bcl-xL双靶点抑制剂Pelcitoclax(APG-1252)以壁报展示形式,分别公布了两项临床数据和一项临床前研究结果。
奥雷巴替尼是亚盛医药在研原创1类新药,是新型的第三代BCR-ABL酪氨酸激酶抑制剂(Tyrosine Kinase Inhibitor,TKI),用于治疗对一代、二代TKI耐药的慢性髓性白血病(CML),特别是对T315I突变的CML患者具有很好的疗效。亚盛医药在中国递交的奥雷巴替尼新药上市申请(NDA)已在审评过程中,用于治疗伴有T315I突变的CML慢性期(CML-CP)及加速期(CML-AP)患者,并已被纳入优先审评。此外,奥雷巴替尼还获中国国家药品监督管理局(NMPA)新药审评中心(CDE)纳入突破性治疗品种,拟治疗一代和二代TKI耐药和/或不耐受的CML-CP患者。
此外,公司细胞凋亡管线重要品种APG-2575治疗血液肿瘤的多中心、开放标签I期单药研究的数据显示,APG-2575具有良好的耐受性,无任何肿瘤溶解综合征(TLS)发生。截止数据分析截点(2021年7月27日),在25例至少完成了一次肿瘤评估的患者中(共入组31例),有9例获得了完全缓解(CR)或部分缓解(PR)。接受200mg及以上剂量治疗的6例慢性淋巴细胞白血病(CLL)受试者均获益,为1例CR和5例PR。
每年一度的ASH年会是全球血液学领域规模最大、涵盖最全面的国际学术盛会之一,汇聚该领域最新、最前沿的研发进展。第63届ASH年会将于2021年12月11日至14日在美国亚特兰大以线下结合线上的形式举行。今年,亚盛医药共有三个在研新药(奥雷巴替尼、APG-2575、APG-1252)的六项临床研究入选ASH年会展示及报告。
亚盛医药首席医学官翟一帆博士表示:“奥雷巴替尼将在2021 ASH年会上展示的临床研究数据展现了良好的疗效和耐受性,令人振奋。该药物的研究进展连续四年入选ASH口头报告,更充分显示了国际血液学界对奥雷巴替尼这一潜在CML治疗药物的认可。作为中国首个、全球第二个三代BCR-ABL抑制剂,奥雷巴替尼为耐药CML患者提供了一种疗效确切、安全性更好的治疗方案。我们迫切地期待奥雷巴替尼早日获批上市,从而造福中国乃至全球的耐药CML患者。”翟一帆博士同时指出:“这次也是公司细胞凋亡重要品种APG-2575和APG-1252首次在ASH年会上亮相,同样显示了国际血液学界对两项在研品种价值与临床优势的关注和认可。本次ASH年会上展示的良好数据让我们备受鼓舞,特别是APG-2575的相关数据证明了其卓有潜力的疗效和安全性数据。APG-2575是首个在中国进入临床阶段、本土研发的Bcl-2选择性抑制剂,我们将加速推进该品种在血液肿瘤方面的临床开发,期待能早日惠及患者。”
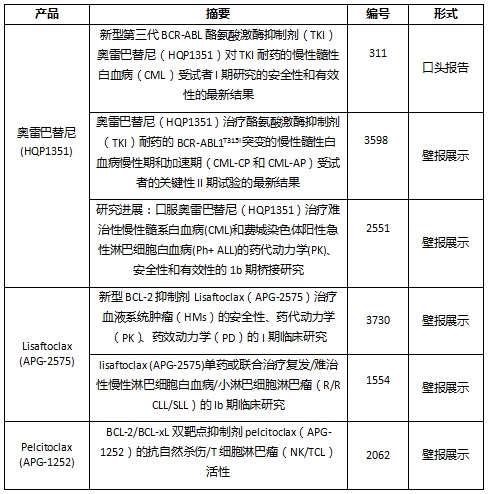
奥雷巴替尼及APG-2575入选2021 ASH年会的研究摘要如下:
新型第三代BCR-ABL酪氨酸激酶抑制剂(TKI)奥雷巴替尼(HQP1351)对TKI耐药的慢性髓性白血病(CML)受试者I期研究的安全性和有效性的最新结果
展示形式:口头报告
摘要编号:311
分会场:632. Chronic Myeloid Leukemia: Clinical and Epidemiological: Mechanisms of resistance and expanded therapies(慢性髓性白血病:临床及流行病学进展:抗药机制及新兴疗法)
报告时间:美国东部时间2021年12月11日,星期六,5:00 PM /北京时间2021年12月12日,星期日,6:00 AM
核心要点:
1. 这项在中国进行的开放性、多中心的I期临床试验评估了奥雷巴替尼对处于慢性期(CML-CP)或加速期(CML-AP)的成人CML受试者的安全性和有效性。符合条件的受试者包括对第一代或第二代TKIs耐药或不耐受的CML-CP或CML-AP患者。奥雷巴替尼的使用方式为口服、隔天给药、28天为一个周期,共有范围从1至60 mg的11个剂量组。本研究报告了有长期随访记录的受试者数据。
2. 2.2016年10月26日至2021年2月2日(数据截止日期)期间,101例CML-CP(n=86)和CML-AP(n=15)受试者被纳入研究并接受奥雷巴替尼的治疗。71例(70.3%)受试者为男性,中位(范围)年龄为40(20-64)岁。从诊断为CML到第一次服用奥雷巴替尼的中位(范围)时间间隔为6.0(0.3-15.2)年。84例(83.2%)受试者之前接受过≥2种TKI-治疗,63例(62.4%)受试者存在T315I突变。11例(10.9%)受试者在基线时被检测出有复合突变,其中7例(63.6%)具有BCR-ABL1T315I的基因突变。共20例(19.8%)受试者有2个(n=13)或≥3个(n=7)突变。中位随访时间为30.8(1.2-51.8)个月。至数据截止日,在101例受试者中有81例(80.2%)继续接受治疗,18例(17.8%)的治疗时间超过3年,5例(5%)的治疗时间超过4年。
3. 3.基线时未获得缓解的可评估受试者中,血液学完全缓解率(CHR)为97.0%,细胞遗传学完全缓解率(CCyR)为62.1%,深度分子生物学缓解率(MMR)为51.0%。
- 在CML-CP受试者中,携带T315I突变的可评估受试者的CHR为100%, 显著细胞遗传学缓解率(MCyR)为83.7%的,MMR为71.2%;
- 在CML-AP受试者中,CHR为80.0%,MCyR和MMR均为54.5%。
在第36个月时,CML-CP和CML-AP受试者的无进展生存(PFS)率分别为96.3%(89.1%-98.8%)和71.4%(40.6%-88.2%)。
奥雷巴替尼带来的缓解是持久的,且不受基线BCR-ABL1突变状态的影响。治疗时间超过4年的受试者的CHR为100%,CCyR为80%,MMR为60%。平均PFS率在第36个月时为100%,第48个月时为100%,而在第60个月时尚未达到(NR-NR)。
4.大部分与治疗相关的不良事件为1级或2级。
- 最常见的非血液学不良事件(大部分为1或2级)是皮肤色素沉着(86.1%);3级或以上的非血液学不良事件包括高甘油三酯血症(10.9%)、发热(6.9%)和蛋白尿(5.0%)。
- 最常见的与治疗相关的血液学不良事件为78例(77.2%)患者出现的血小板计数减少,其中包括52例(51.5%)≥3级不良事件;21例(20.8%)受试者的白细胞计数减少为3级或以上,但不严重;16例(15.8%)受试者的贫血为3级或以上。
结论:奥雷巴替尼对TKI耐药的CML-CP或CML-AP和长期治疗的受试者均有良好的疗效和耐受性。
奥雷巴替尼(HQP1351)治疗酪氨酸激酶抑制剂(TKI)耐药的BCR-ABL1T315I突变的慢性髓性白血病慢性期和加速期(CML-CP和CML-AP)受试者的关键性II期试验的最新结果
展示形式:壁报展示
摘要编号:3598
分会场:632. Chronic Myeloid Leukemia: Clinical and Epidemiological: Poster III (慢性髓性白血病:临床及流行病学进展:壁报展示III)
报告时间:美国东部时间2021年12月13日,星期一,6:00 PM – 8:00 PM / 北京时间2021年12月14日,星期二,7:00 AM – 9:00 AM
核心要点:
1. HQP1351-CC201和HQP1351-CC202是在中国进行的开放性、单臂、多中心的关键性注册II期临床研究,分别评估了奥雷巴替尼对TKI耐药(BCR-ABL1T315I突变)的CML-CP和CML-AP成人受试者的安全性和有效性。奥雷巴替尼的使用方式为40 mg口服、隔天给药、28天为一个周期。
2. 截至2020年8月25日,HQP1351-CC201共入组41例CML-CP患者,其中32例(78%)完成了≥12个周期,中位随访时间为13(3.1-16.3)个月。基线时没有反应的受试者在≥12个治疗周期后,CHR达到100%。MCyR为75.6%(31/41),CCyR率为68.3%(28/41),MMR为56.1%(23/41)。受试者在第12个月的PFS率为89.3%, 总生存(OS)率为100%。
3. 截至2020年7月27日,HQP1351-CC202共入组23例CML-AP患者,其中14例(61%)完成了≥12个周期,中位随访时间为13.5(1.4-15.2)个月。基线时没有反应的受试者在≥12个治疗周期后,血液学深度缓解率(MaHR)达到73.9%(17/23),MCyR为52.2%(12/23),CCyR为47.8%%(11/23),MMR为39.1%(9/23)。受试者在第12个月的PFS率为74.1%, OS率为91.3%。
4. 在HQP1351-CC201中最常见的3级/4级治疗相关不良反应(TRAE)是血小板减少(48.8%),没有治疗相关性死亡发生。
5. 在HQP1351-CC202中最常见的3级/4级TRAE是血小板减少(56.5%)。
结论:奥雷巴替尼单药治疗在TKI耐药的CML-CP和CML-AP以及BCR-ABL1T315I突变的CML受试者中均有良好的疗效和耐受性。
研究进展:口服奥雷巴替尼(HQP1351)治疗难治性慢性髓系白血病(CML)和费城染色体阳性急性淋巴细胞白血病(Ph+ ALL)的药代动力学(PK)、安全性和有效性的1b期桥接研究
展示形式:壁报展示
摘要编号:2551
分会场:632. Chronic Myeloid Leukemia: Clinical and Epidemiological: Poster II(慢性髓性白血病:临床及流行病学进展:壁报展示II)
时间:美国东部时间2021年12月12日,星期日,6:00 PM – 8:00 PM / 北京时间2021年12月13日,星期一,7:00 AM – 9:00 AM
核心要点:
1. 这项在美国开展的开放性的桥接试验旨在评估奥雷巴替尼对伴有或不伴有T315I突变的慢性期、加速期或急变期CML (CML-CP、CML-AP或CML-BP)和Ph+ ALL的成人受试者的药代动力学(PK)、安全性和有效性。奥雷巴替尼的使用方式为口服、隔天给药。
2. 目前,这项研究正在招募受试者,筛选合格的受试者将被随机分配到3个剂量组:30、40或50mg。研究终点包括PK,抗肿瘤活性和安全性。
新型BCL-2抑制剂lisaftoclax(APG-2575)治疗血液系统肿瘤(HMs)的安全性、药代动力学(PK)、药效动力学(PD)的I期临床研究
展示形式:壁报展示
摘要编号:3730
分会场:642 慢性淋巴细胞白血病-临床和流行病学海报展示III
报告时间:2021年12月13日(美东时间)
核心要点:
1. 这是一项在中国进行的多中心、开放性I期单药研究,旨在评估lisaftoclax治疗复发/难治性成人CLL或非霍奇金淋巴瘤(NHL)的安全性(包括剂量限制毒性[DLT]和最大耐受剂量[MTD])、疗效以及PK、PD。
2. 截止2021年7月27日,本研究入组的31例受试者分别接受了lisaftoclax治疗,剂量水平从最低20mg至最高800mg,接受治疗的中位周期数为4个周期(1-14),共包括9例CLL/SLL、6例套细胞淋巴瘤(MCL)、3例边缘区淋巴瘤(MZL)、8例滤泡淋巴瘤、2例弥漫性大B细胞淋巴瘤、1例淋巴浆细胞样淋巴瘤/华氏巨球蛋白血症(LPL/WM)、1例血管免疫母细胞性淋巴瘤(AITL)和1例蕈样霉菌病(MF)。无DLT发生,无实验室和临床TLS发生,未达MTD。II期推荐剂量(RP2D)为600mg。
3. lisaftoclax的耐受性良好。28例受试者中观察到的治疗相关不良事件(TRAE)大多数为1-2级。常见TRAE(>10%)包括血小板计数降低(34.4%)、贫血(28.1%)、中性粒细胞计数降低和白细胞数降低(均为21.9%)、高尿酸血症和腹泻(均为15.6%)、高磷血症和高甘油三酯血症(均为12.5%)。7例受试者发生了3-4级TRAE,包括血小板计数降低(18.8%)、中性粒细胞计数降低(12.5%)、白细胞数降低(9.4%)、贫血/6.3%)。1例受试者发生2项药物相关(严重不良事件)SAE,分别为贫血和血小板计数减少(均为3.1%)。
4. 共有25例受试者至少完成了一次肿瘤评估,其中9例获得了CR或PR,中位起效时间为2个治疗周期。CLL/SLL获得最高缓解率(66.7%),接受200mg及其以上剂量lisaftoclax治疗的所有6例CLL受试者均获益,包括1例CR和5例PR。2例MZL(66.7%)和1例MCL(25%)获得PR。1例MF受试者在经过1个周期lisaftoclax治疗后,皮肤肿瘤包块表现出不同程度的缩小。100mg及其以上剂量组可观察到不同程度的淋巴细胞绝对值(ALC)下降。
5. 初步PK结果显示lisaftoclax暴露量随着20mg至800mg剂量水平的增加而不断增高,平均半衰期为4-6小时。lisaftoclax作为BH3类似物能够快速触发CLL/SLL受试者血标本中BCL-2复合物变化,从而快速降低患者外周血ALC水平。
结论:lisaftoclax耐受性良好,每日口服剂量最高可达800mg。受试者接受每日剂量递增进行快速爬坡,无任何TLS发生。与venetoclax相比,亦未观察到任何新的或不可控的TRAE。因此,lisaftoclax为R/R HMs患者提供了一项安全且有效地新的治疗选择。
lisaftoclax (APG-2575)单药或联合治疗复发/难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(R/R CLL/SLL)的Ib期临床研究
展示形式:壁报展示
摘要编号:1554
Abstract: 1554
分会场:642. Chronic Lymphocytic Leukemia: Clinical and Epidemiological(慢性淋巴细胞白血病:临床和流行病学)
Session: 642. Chronic Lymphocytic Leukemia: Clinical and Epidemiological
报告时间:美国东部时间2021年12月11日,星期六;5:30 PM – 7:30 PM / 北京时间2021年12月12日,星期日,6:30 AM – 8:30 AM
核心要点:
1. 这是一项全球多中心、开放性Ib/II期研究。该研究分为两个阶段,第一阶段为lisaftoclax单药,第二阶段为lisaftoclax联合阶段,研究主要目的是评估安全性和耐受性。
2. 第一阶段采用标准的3+3爬坡设计,lisaftoclax单药每日口服,连续28天。起始剂量为200mg,然后400mg、600mg、800mg、1000mg,直到1200mg。为了降低TLS的风险,lisaftoclax采用更为便利的每日梯度剂量递增方式。
3. 第二阶段为lisaftoclax联合利妥昔单抗或阿卡替尼的3+3爬坡设计的剂量递增,之后在RP2D上进行扩展。
4. 截止2021年7月19日,71例患者完成入组(研究计划的入组总例数为144例)。
APG-1252入选2021 ASH年会的研究摘要如下:
BCL-2/BCL-xL双靶点抑制剂pelcitoclax(APG-1252)的抗自然杀伤/T细胞淋巴瘤(NK/TCL)活性
展示形式:壁报展示
摘要编号:2062
分会场:203. Lymphocytes and Acquired or Congenital Immunodeficiency Disorders (淋巴细胞和先天性或获得性免疫缺陷)
Session: 203. Lymphocytes and Acquired or Congenital Immunodeficiency Disorders
报告时间:美国东部时间2021年12月12日,星期日;6:00 PM – 8:00 PM / 北京时间2021年12月13日,星期一;7:00 AM – 9:00 AM
核心要点:
1. 这是一项旨在评估APG-1252在NK/TCL临床前模型中的潜在抗肿瘤作用的研究。基于细胞的抗增殖研究显示,APG-1252及其更有效的代谢物APG-1252-M1对过表达BCL-xL的NK/TCL细胞系有抗增殖活性。APG-1252在SNK-1、SNK-6和SNK-8(EBV阳性NK/TCL)细胞系中IC50分别为2.652±2.606μM、1.568±1.109μM和0.557±0.383μM。APG-1252-M1的相应IC50分别为0.133±0.056μM、0.064±0.014μM和0.020±0.008μM。
2. 机理研究表明,APG-1252和APG-1252-M1破坏了SNK-6细胞中BCL-XL与BAX或BAK的复合物,从而释放这些促凋亡蛋白,并通过切割PARP-1和caspase-3进一步激活下游凋亡途径。在SNK-6异种移植模型中,以每周两次65mg/kg或每周一次100mg/kg给药,APG-1252表现出显着的抗肿瘤作用,肿瘤生长速率(T/C%)为13.7%至30.7%。
3. 此外,APG-1252与HDAC抑制剂西达本胺或DDGP(地塞米松、顺铂、吉西他滨和门冬酰胺酶)的化疗组合联用显示出协同效应。小鼠药代动力学评估显示APG-1252在血浆和肿瘤组织中具有较长半衰期,分别为127小时和25.2小时。重要的是,APG-1252给药后,肿瘤组织中APG-1252向APG-1252-M1的转化率比血浆中的转化率高16倍(22%对1.3%),提示APG-1252可降低血浆中APG-1252-M1引起的血小板毒性。
结论:无论是作为单一药物还是与HDAC抑制剂或化疗联合,APG-1252在NK/TCL中具有良好的抗肿瘤作用。这些发现为进一步评估APG-1252作为NK/TCL的潜在治疗方案提供了证据。






