中期业绩发布后,基石药业-B(02616)大涨超过6个点。
智通财经APP观察到,8月26日盘后基石药业发布了2021年上半年业绩公告,期内实现收入7945万元人民币(单位下同),去年同期收入则为0。公告称收入增加主要是公司药品阿伐替尼和普拉替尼销售产生,期内销售收入分别为3360万元和4580万元。
而这是基石药业继去年下半年获得授权性收入之后,首次实现药品销售收入,积极意义明显。与此同时,公告显示公司在管线研发、产品商业化、外部合作层面都取得了显著进展。
年初至今,公司已获批三项新药上市申请 (NDA),递交四项NDA,另有两款同类首创/潜在同类最优的产品舒格利单抗和艾伏尼布获批在即,多项注册性临床试验正在积极推进中。这充分展现了公司高效的研发和突出的商业化能力
销售收入现突破 现金流保持充裕
智通财经APP观察到,上半年公司产品普拉替尼(普吉华)用于RET融合阳性NSCLC在中国大陆获批,阿伐替尼片(泰吉华)用于治疗PDGFRA外显子18突变的胃肠道间质瘤(GIST)获批。
而基石药业在产品商业化方面已经有了充足准备,与医疗服务供应商、监管机构、医院、药房和付款方及其他团体合作,进行产品教育,扩大获得该产品的患者数目,因此公司以超出市场平均的速度推出这两款药物,并实现快速销售增长。
除了销售收入实现突破,基石药业仍然继续加码研发和销售投入。上半年集团研发开支达到5.13亿元,对于重点临床试验及临床前研究持续投资,另一方面公司在临床开发方面进行了一系列优化措施,做到资金利用效率最大化。
不过基石药业的现金流十分充足,可以满足公司在研发和销售方面的开支。公告显示,截至6月30日,公司拥有现金及现金等价物24.47亿元,同期流动负债仅为4.67亿元,不仅完全覆盖短债,还可满足较长时间集团的开支。
成熟管线开启商业化 在研管线加速推进
目前,基石药业拥有15条研发管线,其中普拉替尼和阿伐替尼已经上市,此外舒格利单抗和艾伏尼布新药上市申请获批在即。
普吉华(普拉替尼)作为中国首个获批的选择性RET抑制剂,主要用于含铂化疗后的局部晚期或转移性RET融合阳性NSCLC成人患者,亦是基石药业首个获批精准治疗药物。
4月份,国家药监局受理了具有优先审评资格的治疗晚期或者转移性RET突变MTC及RET融合阳性甲状腺癌患者的NDA。6月份公司宣布相关数据与先前公布的全球临床数据基本一致。
6月份,关于RET融合阳性NSCLC患者的I/II期ARROW试验数据与全球临床数据一致,公司预期将于2021年下半年向国家药监局递交该适应症NDA。另外公司也将向TFDA、香港卫生署递交相关NDA,推进新药上市。
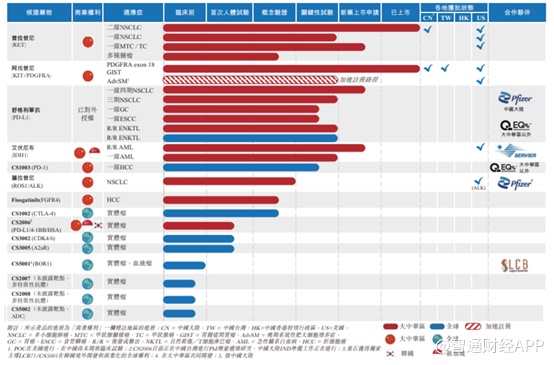
阿伐替尼是基石另外一款拳头产品,也是目前中国市场唯一一种正处于临床开发阶段的KIT和PDGFRA抑制剂,在大陆地区基石药业在此类药物的临床开发方面处于绝对领先地位。2021年3月31日,基石药业宣布国家药监局批准了泰吉华(阿伐替尼片)新药上市申请,用于治疗PDGFRA外显子18突变的胃肠道间质瘤(GIST),而阿伐替尼属于同类首款产品。
今年二季度以来,阿伐替尼用于治疗携带PDGFRA D842V突变的不可切除或转移性GIST成人患者,分别在TFDA和香港获得审批和受理。在美国市场,合作伙伴Blueprint Medicines宣布阿伐替尼用于治疗晚期SM获得美国FDA批准,而公司也在计划与国家药监局沟通该适应症在中国的注册途径。
普拉替尼和阿伐替尼获批之后,为了筹备候选药物上市工作,基石药业在商业化建设方面持续发力。智通财经APP观察到,上半年基石药业通过与医疗界利益相关者广泛深入合作,不断壮大的商业团队为首批商业化产品上市做足准备。
例如积极与医疗界相关者合作扩大公司市场辐射范围,覆盖超过130个城市的400多家医院,加深各方之间的联系。公司的销售团队正在就产品在中国建立全面市场覆盖,已经覆盖的亿元占精准治疗药物相关市场的70%-80%,同时努力推进精准治疗药物纳入20项主要商业及政府保险计划,为将来产品上市铺平道路。
为推进产品分销,公司还与国药控股签署战略合作协议。就目前已上市的普吉华和泰吉华而言,扩大了在中国大陆医院和药房的分销范围。还通过与中国上海自贸区临港片区合作,四天内完成通关及口岸检查程序,缩减了通关时间提升了效率。与中国大陆三大综合医疗服务平台——上海镁信、北京圆心、思派健康科技达成合作协议,提升产品分销和患者负担能力。
而这一切商业化布局,都为未来新产品上市铺平了道路,大大减少了产品获批到市场销售之前的时间,提升了运营效率,也减少了由此带来的业绩波动。
其他在研管线也取得了不同程度的突破,为新药上市奠定了基础。
艾伏尼布是另外一款推进迅速的管线,目前用于治疗IDH1突变复发/难治性急性髓系白血病已经在台湾地区获批,同时在新加坡递交了新药申请
7月份以来,艾伏尼布治疗IDH1突变的R/R AML患者的中国注册性试验达到预先设定的研究终点,8月份获得国家药监局受理并获得有限评审资格,预计最快2021年底获得NDA批准。
而且在8月份,公司合作伙伴施维雅发布有关艾伏尼布与阿扎胞苷联合治疗未经治疗的IDH1突变急性髓系白血病的全球III期研究正面顶线数据,由于疗效优异该研究停止进一步入组,预计2022年向国家药监局递交NDA。
公司非常值得一提的还包括其自主研发的舒格利单抗(PD-L1)。作为一种全人源全长抗PD-L1单克隆抗体,舒格利单抗是一种最接近人体的天然G型免疫球蛋白4(IgG4)单抗药物。与同类药物相比,其在患者体内产生免疫原性及相关毒性的风险更低,这使得舒格利单抗在安全性方面具有独特的优势,并且数据证实其有潜力成为同类最佳PD-L1。截至6月30日,临床试验已经用舒格利单抗实现超过1500名患者给药。
目前,公司就舒格利单抗进行五项注册性试验,包括2018年启动的III期NSCLC、IV期NSCLC和ENKTL,2019年启动的晚期胃癌和食管癌。其中关于III、IV期NSCLC适应症已经递交或获得受理,最快有望今年年底获得NDA批准。
另外,舒格利单抗联合fisogatinib、donafenib用于不同的适应症的试验也在顺利推进,在多种联合疗法方面有望获得突破。其他管线如CS1002、CS1003、CS3002、CS3005、CS3008等也都取得了不同程度的研究进展,尤其是为公司的联合疗法提供了有力的支持,为基石的可持续增长奠定了基础。
管线2.0顺利推进 国际合作提升研发实力
同样值得关注的是基石药业的产品管线2.0。伴随着产品上市,公司的研发平台趋于成熟,基石药业还将依靠已建立的特有的高效研发平台,利用生物创新生态圈的协同优势,不断推出同类首创/同类最佳的肿瘤药物或疗法,如抗体偶联药物(ADC)、多特异性抗体等,增强自身持续创新的竞争力。
期内基石药业继续深化与全球主要战略合作伙伴的合作关系。如与辉瑞进行合作,准备在中国大陆对用于治疗IV期NSCLC的舒格利单抗进行全面商业上市。另外还与辉瑞达成协议在大中华区联合开发辉瑞的后期肿瘤资产劳拉替尼用于二线治疗ROS1阳性NSCLC,这是继去年达成战略合作后,双方合作的进一步延伸,是临床研发及双方关系的重要进展。
基石和EQRx共同与美国、英国及欧盟等全球主要市场的利益相关者就舒格利单抗治疗NSCLC适应症的注册进行洽谈。与EQRx合作探究扩大该药物适应症范围之可行性(包括胃癌、食管癌),还与之合作在美国及欧盟市场扩大CS1003治疗HCC的III期研究。
就目前而言,随着基石药业上市产品开始放量,盈利能力逐渐显现。而考虑到在研产品研发和商业化能力的搭建,以及基石药业管线的首创性、独特性,未来业绩的持续性和爆发力也将得以保证。






