本文来自微信号“生物制品圈”。
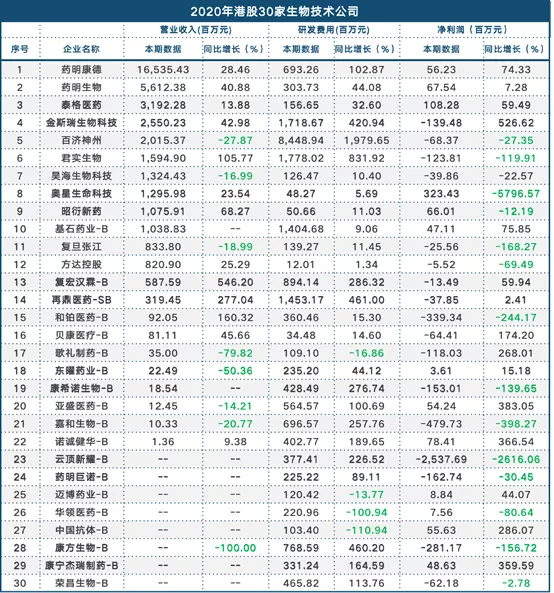
近日,港股多家生物技术公司公布了2020年业绩表现,根据营业收入排名前5的公司销售额均超过20亿元;研发投入方面超过10亿元的企业分别为:百济神州(06160)84.48亿元、君实生物(01877)12.78亿元、金斯瑞生物科技(01548)12.18亿元、再鼎医药(09688)-SB 14.53亿元。
接下来公司来详细看一下这30家企业2020年重大事件、在研项目情况。

【企业介绍】
为全球生物医药行业提供全方位、一体化的新药研发和生产服务。通过赋能全球制药、生物科技和医疗器械公司,药明康德致力于推动新药研发进程,为患者带来突破性的治疗方案。本着以研究为首任,以客户为中心的宗旨,助力客户提升研发效率,服务范围涵盖化学药研发和生产、细胞及基因疗法研发生产、医疗器械测试等领域。自2019年起,药明康德连续两年在MSCI的ESG(环境、社会及管治)评级中获得A级。
【主要业绩与成绩】
一、小分子药物发现(一)化学FFS服务收入取得了超过35%的增长(二)较早发展新冠病毒小分子药物发现平台,在全球赋能了77名客户(三)HitS平台赋能全球大于500名客户,获得收入约1.96亿元,增速约43%
二、研发&申报一体化服务(一)药物安全性评价服务收入取得了约74%增速。公司临床前评价所用动物资源储备充足,为后续业务的强劲增长提供保障(二)WIND平台签约100个服务项目
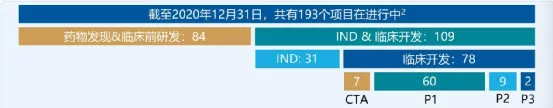
三、服务费+里程碑分成(一)2020年为客户完成33个IND申报,并获得30个CTA(二)累计为客户完成118个IND申报,并获得87个CTA(三)2个项目处于III期临床试验;9个项目处于II期临床试验;60个项目处于I期临床试验
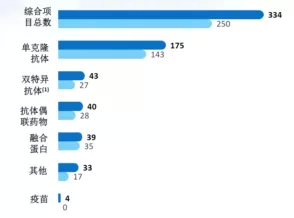
【在研项目概览】

【企业介绍】
上海药明生物技术有限公司是药明康德集团旗下的生物制药研发、生产服务企业,成立于2011年,在无锡、上海、苏州均有分公司。作为广大创新公司实现新药研发梦想的平台,未来有望为更多国内外创新生物医药技术公司提供国际水准的一体化生物制药研发生产服务,加速创新生物药在中国的上市进程,造福广大病患。
【主要业绩与成绩】一、领先的前沿技术(一)WuXiBody双抗技术平台(通用性、节省6-18个月、最小CMC挑战)(二)ADC(DAR4显著改善、专属生产设施、10+已申报IND项目)(三)Wuxia细胞系平台(高表达细胞系、良好过往记录)(四)WuXIUP连续细胞培养(表达量高达30-90g/L,滴度可达传统技术10倍以上)
二、最优的交付时间(一)新药临床实验申请1、行业平均:18-24个月2、WuXiBio平均:从此前的15个月缩短到6-9个月3、WuXiBio最快记录:7个月,新冠项目<3个月
三、强大的产能支持项目快速启动(一)产能提升:每年可支持新药临床实验申请IND:从60增加到80+个(二)后期项目能力提速,每年可支持上市申请BLA:从5个增加到7个(三)业内最大的研发团队之一:约2800人(四)全球最大使用一次性生物反应技术的产能:2024年后约430,000升
【在研项目概览】

【企业介绍】
杭州泰格医药科技股份有限公司是一家专注于为医药产品研发提供临床试验全过程专业服务的合同研究组织。总部位于杭州,下设33家子公司,在中国内地60个主要城市和香港、台湾、韩国、日本、马来西亚、新加坡、印度、澳大利亚、加拿大、美国等地设有全球化服务网点,拥有超过2500多人的国际化专业团队,为全球600多家客户成功开展了600余项临床试验服务。泰格医药更因参与80余种国内创新药临床试验,而被誉为“创新型CRO”。
【主要业绩与成绩】
一、临床试验技术服务(一)2020年同步实施超过230个创新药项目,覆盖138个国内服务网点和1200余家药物临床试验机构(二)2020年度药品注册服务客户数量同比增长34%,项目累计数量增长30%(三)参与10个新冠核酸检测试剂盒临床试验,扩大医疗器械检测领域,覆盖7大类304个标准(方法)(四)药物警戒服务合同额增长53%,新增超过20家客户,新增项目100余个(五)收购谋思医药,早期临床研究团队的服务能力和规模得到进一步提升(六)合并雅信诚,医学翻译人员规模300余人,年翻译量超过6亿汉字
二、临床试验相关服务及实验室服务(一)2020年度,数据管理和统计分析业务客户数量同比增长超过20%,项目数量同比增长超过30%,全球数统专业人员超过600人(二)方达在上海完成对现有生物分析实验室设施的升级,在苏州扩增2万平方米实验室空间(三)方达美国实验室建立了高要求的定量全身放射自显影(QWBA)基地(COE)(四)思默医药已入选50余家临床试验机构的优选SMO名单,为国内1000余家医院提供专业服务(五)影像分析业务新增客户18家,并助力3款新药及器械成功上市
三、扩大和完善全球布局(一)截止2020年12月31日,海外临床运营和全球项目团队覆盖了所有主要大洲(二)进行中的国际多中心临床实验项目(MRCT)20余个,项目覆盖北美、南美、亚太和欧洲等21个国家地区,涉及13个疾病领域(三)子公司DreamCIS在韩国成功上市

【企业介绍】
金斯瑞生物科技股份有限公司是全球化生物科技集团公司。金斯瑞生物科技植根领先的基因合成技术,业务范围涵盖生命科学服务及产品、生物酶及合成生物学产品、生物药开发与生产服务、细胞治疗四大领域。金斯瑞公司成立于2002年,并于2015年在港交所主板挂牌上市。
总部位于中国南京,运营实体遍布大中华区、北美区、欧洲区及亚太区,并以此为依托,为全球160多个国家和地区的30多万客户提供服务与产品。在全球拥有3000多名员工,其中34%以上的员工拥有硕士或博士学位。同时,拥有多项知识产权及技术机密,其中包含100多项授权专利及270多项专利申请。
【主要业绩与成绩】一、收入大幅攀升,增长达44.4%二、自动化升级提升高通量基因合成产能约60%三、蛋白,引物及多肽业务快速增长,成为市场领导者四、推出sgRNA和新生抗原肽等创新型产品五、新冠中和抗体检测试剂盒cPassTM的推出和全球推广六、持续的全球产能扩增

【企业介绍】
百济神州专注于研究、开发、生产以及商业化创新性药物以为全世界患者提高疗效和扩大药品可及性。本公司在其成立至今的十年中已实现十种分子的临床应用,包括其两种领先的商业药物BRUKINSA®(一种用于治疗各种血癌的布鲁顿酪氨酸激酶(「BTK」)的小分子抑制剂)和替雷利珠单抗(一种抗PD-1抗体免疫疗法,用于治疗各种实体瘤及血癌)。
本公司在美国(「美国」)和中华人民共和国(「中国」)这两个世界上最大的医药市场销售BRUKINSA®,在中国销售替雷利珠单抗,并拥有成熟、科学化的商业组织。本公司已在中国建立先进的生物及小分子生产设施,以支持其产品的潜在未来需求,其亦与优质合约生产机构(「合约生产机构」)合作,生产其自主开发的临床及商业产品。
【主要业绩与成绩】
一、BRUKINSA®(一种用于治疗各种血癌的布鲁顿酪氨酸激酶(「BTK」)的小分子抑制剂)(一)Complete and sustained inhibition,mini mize off-target effects, and access ible pricing(二)Favor able label sin WM,R/RMCL,andR/RCLL/SLL,favorable safety and DDI^(三)Broad clinical program,including:1、9 registration-enabling clinical trials,>20 countries2、> 2500 patients out side of main and China(四)Commitment to quality,global manufacturing World class API manufacturer;Collaboration with Catalentin U.S.
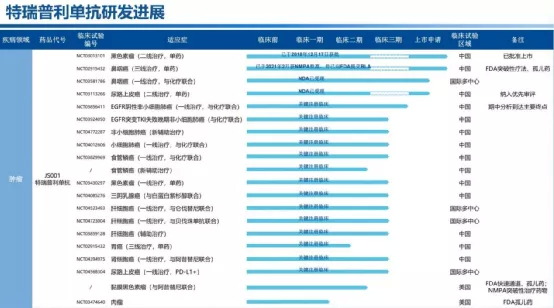
二、替雷利珠单抗(一种抗PD-1抗体免疫疗法,用于治疗各种实体瘤及血癌)(一)Mechanistically differentiated,Fc-γrecept or sparing, and multiple combinations under study(二)Favorable label in cHL and only reimbursed PD-1 inhibitor in bl adder cancer in China(三)Broad clinical program,including:1、16 registration-enabling clinical rials,>20countries2、>2,000 patients outside of main l and China(四)Commitment to quality,global manufacturing Collaboration with one of the world’s leading biologics manufacturers(五)Future global approvals for more places in more indications1、Three approved indications in China:R/RcHL,R/RUC,1LSqNSCLC2、Three filings in China:1Lnon-Sq,2/3LNSCLC and HCC filed3、11 other pivotal or potentially registration-enabling studies on going4、Compelling breadth of combinations: e.g.,ociperlimab, sitravatinib, etc.
【在研项目概览】


【企业介绍】
君实生物是一家创新驱动型生物制药公司,致力于创新药物的发现和开发,以及在全球范围内的临床研发及商业化。利用蛋白质工程的核心平台技术,公司已处在大分子药物的研发前沿。
在中国区域内,凭借卓越的创新药物发现能力、先进的生物技术研发、全产业链大规模生产技术及快速扩大极具市场潜力的在研药品组合,公司在肿瘤免疫疗法、自身免疫性疾病及代谢疾病治疗方面处于领先地位。
公司是国内首家获得抗PD-1单克隆抗体NMPA上市批准、抗PCSK9单克隆抗体NMPA临床申请批准的中国公司,并取得了全球首个治疗肿瘤抗BTLA阻断抗体在中国NMPA和美国FDA的临床申请批准。公司旨在通过源头创新来开发首创(First-in-class)或同类最优(Best-in-class)的药物,并成为转化医学领域的先锋。
随着产品管线的丰富及对药物联合治疗的探索,预计公司的创新领域将扩展至包括小分子药物和抗体药物偶联物(或ADCs)等更多类型的药物研发,以及对癌症和自身免疫性疾病下一代创新疗法的探索。
【主要业绩与成绩】
一、管线扩张,核心产品商业化(一)30项在研产品,包括28个创新药,2个生物类似药,覆盖五大疾病领域
1、核心产品商业化(1)拓益®:纳入国家医保目录;授予Coherus美国和加拿大的独占许可权;授权阿斯利康在中国合作商业推广(2)S016授权礼来,并已获FDAEUA和美国政府采购
二、全球商业拓展(一)2020年5月,与礼来合作研发COVID-19及商业化潜在的预防与治疗性抗体疗法,并授予礼来JS016大中华区以外地区的产品独占许可。
(二)2020年7月,与Revitope合作研发新一代T细胞癌症免疫疗法(PrecisionGATETM)。
(三)2020年8月,从志道生物引进IL-2药物的全球范围权益(四)2020年9月,与IMPACT成立合资公司,共同进行PARPi的临床试验与商业化开发(五)2020年9月,从微境生物引进4项产品(XPO1/AuroraA/EGFRexon20/EGFR4th)(六)2020年9月,与北京恩瑞尼成立合资公司,引进CD39药物在大中华地区的权益(七)2021年2月,与Coherus达成商业化合作,授予JS001美国和加拿大的独占许可(八)2021年2月,与阿斯利康达成商业化合作,授予JS001在中国大陆地区部分推广权。
【在研项目概况】

【企业介绍】
昊海生物科技成立于2007年,是一家专注于研发、生产及销售医用生物材料的高科技生物医药企业。公司于2015年4月30日于香港联交所主板成功上市,并于2019年10月30日在科创板上市,成为首家“H+科创板”生物医药企业。公司策略性地专注于中国医用生物材料市场中快速增长的治疗领域,包括眼科、整形美容与创面护理、骨科、防粘连及止血。
【主要业绩与成绩】
一、在眼科领域,本集团是国内第一大眼科粘弹剂厂商、国际知名人工晶状体及视光材料厂商。根据标点医药的报告,本集团生产的眼科粘弹剂产品2019年中国市场份额为45.85%、连续13年超过四成。本集团旗下各品牌人工晶状体的年销售数量,约占中国市场年使用量的30%。公司下属子公司杭州爱晶伦研制的依镜悬浮型有晶体眼后房屈光晶体(PRL),是国内市场可用于有晶体眼屈光晶体手术的两款核心产品之一,具有很好的成长前景。公司下属子公司Contamac是全球最大的独立视光材料生产商之一,为全球近70个国家和地区的客户提供人工晶状体及角膜塑形镜等视光产品的原材料。
二、在医疗美容领域,本集团研制的“海薇”、“姣兰”两款玻尿酸产品已得到市场广泛的认可,具有线性无颗粒特征的第三代玻尿酸产品“海魅”也于2020年8月正式上市销售。在创面护理领域,本集团利用基因工程技术研发生产的重组人表皮生长因子产品“康合素”为国内唯一与人体天然EGF拥有完全相同的氨基酸数量、序列以及空间结构的表皮生长因子产品,亦是国际第一个获得注册的重组人表皮生长因子产品。根据标点医药的研究报告,本集团重组人表皮生长因子产品2019年市场份额扩大至23.49%,稳居市场份额第2位,进一步缩小了与第一位的差距。
三、在骨科领域,本集团是国内第一大骨科关节腔粘弹补充剂生产商。根据标点医药的研究报告,2019年,本集团已连续六年位居中国骨关节腔注射产品市场份额首位,且市场份额由39.67%持续增至42.06%。
四、在外科防粘连领域,本集团是国内第一大防粘连产品生产商。根据标点医药的研究报告,2019年,本集团生产的手术防粘连产品市场份额为29.64%,连续13年稳居市场首位。
【主要产品】


【企业介绍】
香港奥星集团是一家科技型制药工程解决方案提供商,业务范围遍及全球50多个国家和地。拥有全面的制药行业技术知识,在洁净公用工程、制药自动化和信息化、制药配方工艺科技、生物工艺和技术、合规&卓越运营、实验室科技和设施、生物安全科技和设施、清洁、杀菌、消毒、洁净室/HVAC/EMS/BMS、质量/测量及分析、灌装、冻干及检测、密闭科技领域有领先的技术应用能力和高品质设备和系统。
【主要业绩与成绩】
一、正在建立全球组织架构(一)AUSTARUKLimited在2020年年初成立,拥有制造及设备设计专家及于英国西约克郡哈德斯菲尔德拥有一座设施,该设施已于2021年2月获得ISO9001认证。本集团非全资拥有的附属公司H+EPharmaGmbH(「H+EPharma」)及其在德国德累斯顿的自有装配厂S-TecGmbH于本年度下半年的业务增长较预期慢。
(二)总建筑面积约为31,200平方米的中国上海新製造设施现正建设中,并预计将于2022年第一季度投入营运。
(三)中国南京的新制造中心专注于结合西林瓶灌装系统及无菌密闭隔离器的冻干设备的设计及製造,自2020年最后一个季度起已投入营运。(四)位于中国石家庄的新製造基地现正建设中,旨在为提高生产能力及质量,并最终提高客户满意度。
二、业绩展现(一)至年底,本集团项目执行中心于零感染情况下合共执行合同639份,其中344份已经完成,项目执行中心确认的总收入与2019年同期相比增加了35%。(二)本集团的项目执行中心参与了中国大部分紧急COVID-19疫苗设计及建设项目,并成功参与及支持客户提前完成建设10座COVID-19疫苗设施度及安全性。(三)建筑信息模型(BIM)软件于2020年成功用于项目,提高了项目执行的效率,减少了错误并改善了可视化效果。

【企业介绍】
昭衍新药是中国最早从事药物非临床评价的民营CRO企业,1995年成立至今,拥有超过1500人专业技术团队,在北京、苏州、重庆、梧州以及美国旧金山、波士顿设有子公司。昭衍新药建立有符合国际规范的质量管理体系(CNAS/ILAC-MRA认证),具备中国NMPA、美国FDA、经合组织OECD、韩国MFDS的GLP资质以及国际AAALAC(动物福利)认证资质。可以向客户提供药物筛选、药效学研究、药代动力学研究、安全性评价、临床试验、药物警戒的一站式的药物评价服务;还可以提供实验动物、食品动物/兽药评价、农药评价,医疗器械评价等服务项目。
【主要业绩与成绩】
一、临床前业务(一)COVID-19疫苗及药物评价能力的发展于2020年,承接的COVID-19疫苗非临床研究项目佔COVID-19疫苗新药临床试验申请的50%以上。
(二)特色领域的能力发展已将经过验证的非人类灵长类动物生殖毒性评价系统推广至商业用途,是目前中国首个将该项技术商业化的非临床合同研究组织。
(三)开展生殖毒理学测试于2020年,大量生物技术药物开始逐步进入生产阶段。
二、药物临床试验服务于2020年,公司组织国内外客户对共建临床中心一期病房进行多次现场审核。共建临床中心已进行多项创新药物的第I阶段临床试验及仿製药的BE试验。
三、动物模型研究于2020年,本公司的附属本公司苏州启辰生物科技有限公司组建了一支具有强大技术研发能力的完整技术团队。
四、广西梧州实验动物基地建设动物检疫区的建设已于2019年11月开始。当前检疫区的建设已通过竣工验收,而繁殖区的建设一直有序进行。54幢猴房、一幢厂区办公楼及一幢饲料房(合共56幢)的地基工程已经竣工。
五、营销工作(一)非临床业务的新客户为231名,活跃客户为520名(二)全年非临床业务的新签订单超过15亿,较去年同期增长约70%

【企业介绍】
基石药业是一家生物制药公司,专注于开发及商业化创新肿瘤免疫治疗及精准治疗药物,以满足中国和全球癌症患者的殷切医疗需求。成立于2015年底,基石药业已集结了一支在新药研发、临床研究以及商业化方面拥有丰富经验的世界级管理团队。公司以肿瘤免疫治疗联合疗法为核心,建立了一条14种肿瘤候选药物组成的丰富产品管线,其中6款后期候选药物正处于关键性临床试验或注册阶段。
【主要业绩与成绩】
一、为关键后期治疗药物递交多项新药申请(一)普拉替尼:二线RET融合阳性非小细胞肺癌(中国大陆)(二)阿伐替尼:PDGFRA外显子18突变胃肠道间质瘤(中国大陆/台湾)(三)舒格利单抗:一线四期非小细胞肺癌(中国大陆),针对该适应症的潜在同类最佳药物
二、后期管线取得额外重大成就
(一)舒格利单抗:获美国食品和药物监管局(FDA)就用于治疗患有T细胞淋巴瘤患者的孤儿药资格以及FDA与中国药监局就用于治疗患有复发/难治节外NK/T细胞淋巴瘤患者的突破性疗法认证
(二)舒格利单抗:完成用于三期非小细胞肺癌患者的III期临床试验的患者招募
(三)CS1003(PD-1):开展与乐卫玛(LENVIMA®)联合用于肝细胞癌的全球III期试验,并获FDA授予孤儿药资格
三、进一步建立强大商业化能力
(一)建立成熟商业化团队,整体团队规模达到约200人(二)在博鳌先行区成功上市普拉替尼与阿伐替尼(三)与行业利益相关方建立可信赖的联系,从而支持产品上市
四、实施变革性的商务拓展计划
(一)与辉瑞订立多维度战略合作
(二)独家授权EQRx在大中华区以外地区开发及商业化舒格利单抗和CS1003,最大化全球商业潜力
(三)获得在韩国以外地区开发和商业化一款潜在同类最佳的ROR1抗体偶联药物的独家授权
五、提升研究实力并推进管线2.0
(一)开发多款具备全球权益的抗体偶联药物与多特异性抗体
(二)进一步优化研究组织,充分利用临床洞察,强化内源创新
(三)优化早期管线重点,聚焦同类首创或同类最佳药物
【在研项目概况】


【企业介绍】
上海复旦张江生物医药股份有限公司,一九九六年十一月创建于上海浦东张江高科技园区,由知名企业如上海医药集团股份有限公司等作为公司股东。凭籍在生物医药领域的实力,公司多次承担“国家重点科技项目(攻关)计划”、“国家高技术研究发展计划(八六三计划)”、“‘重大新药创制’科技重大专项”等。一九九八年以来,复旦张江被连续认定为上海市“高新技术企业”;一九九九年,公司被国家人事部批准为“企业博士后科研工作站”。于二零零二年八月,公司在香港创业版成功上市(股票代码:8231),并于二零一三年十二月,转往香港主板上市(股票代码:01349)。二零二零年六月,公司在上海证券交易所科创板上市交易(股票代码:688505)。至此,复旦张江成为于A+H两地上市的公司之一。
【主要业绩与成绩】
一、艾拉®于二零零七年上市销售,作为国内首个光动力药物,二零二零年为集团贡献之销售收入与上一年相比,减少35%。
二、治疗肿瘤的里葆多®于二零零九年八月上市销售,是国内外首个纳米药物的仿制药物。报告期内,里葆多®为集团贡献之销售收入与去年同期相比,减少2%。
三、治疗鲜红斑痣的复美达®(海姆泊芬之商品名),全球首个针对鲜红斑痣的光动力药物,是集新药靶、新化合物和新适应症于一体的新药。二零二零年为集团贡献之销售收入与上一年相比,减少7%。
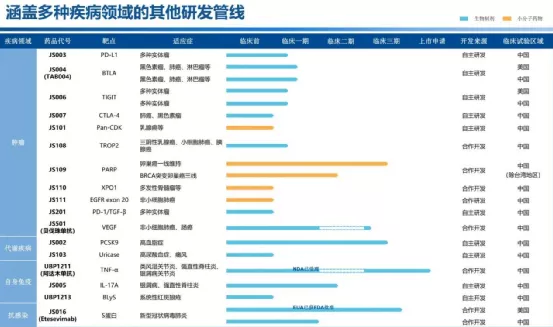
四、本公司的附属公司泰州复旦张江药业有限公司已建成两条生产线,分别用于海姆泊芬原料药及注射剂的生产。其中针对镇痛领域的帕瑞昔布钠已于二零二一年初获得中国NMPA颁发的药品注册证书,将尽快安排上市销售。
五、本公司的附属公司上海溯源生物技术有限公司作为本集团相对独立的体外诊断试剂板块,其经营涵盖诊断试剂的研发、生产及销售各个环节。报告期内,溯源生物利用基因编辑(CRISPR-Cas)技术用于动物微生物检测,已经取得一定的效果并开发出奶牛的五种传染性疾病的检测试剂。该类试剂计划于2021年投入使用。
【在研项目概况】

【企业介绍】
方达医药是全方位一体化的医药研发合同研究组织(CRO),在药物发现到开发过程中能够提供综合的、立足科学的分析研究和开发服务,致力于为制药公司提供高品质的服务。方达医药为仿制药、创新药公司提供全方位的产品开发服务,以支持IND(新药临床申请)、NDA(新药上市申请)、ANDA(仿制药)和505(b)(2)的注册申报。公司与客户紧密合作,确保深入了解其药物开发目标,以便提供灵活的解决方案,满足每个客户的需求。
【主要业绩与成绩】
一、产能、研发能力增强在宾夕法尼亚州埃克斯顿、新泽西州锡考克斯、中国上海扩大中心实验室能力;在宾夕法尼亚州埃克斯顿扩大化学、制造和控制、生物分析及中心实验室产能及能力;在宾夕法尼亚州埃克斯顿扩大QWBA及hAME能力;在俄亥俄州康科特建立遗传毒理学及安全药理学与申请IND的全方位体内和体外研究;在加利福尼亚州海沃德的生物分析实验室扩大产能及能力;在中国上海扩大生物分析产能及能力,以支持生物药物开发、生物标记物以及细胞及基因疗法;在中国苏州扩大药物代谢和药代动力学及安全和毒理学服务;在中国苏州扩大化学、制造和控制
二、股权投资2020年3月31日,FrontageLabs以总代价约2.4百万美元收购Biotranex的全部股权。
三、荣誉奖项FrontageLabs再次被生命科学领导者(LifeScienceLeader)杂志评选为合同研究机构领导大奖的得奖者;被PharmaTechOutlook评选为2020年十大CRO供应商;被InsightSuccess评选为2020年十大最创新制药及生物技术解决方案提供商;被MedhealthOutlook评选为2020年十大CRO解决方案提供商;被评选为2020年中国研发CRO企业20强。

【企业介绍】
复宏汉霖是一家国际化的创新生物制药公司,致力于为全球患者提供质高价优的创新生物药,产品覆盖肿瘤、自身免疫疾病、眼科疾病等领域。2016年,复宏汉霖于上海市漕河泾新兴技术开发区建成以一次性生物反应器等设备为核心技术的生物药生产基地,目前该基地配套的质量管理体系已通过多项由中国国家药监局、欧洲药品管理局、欧盟质量受权人(QP)以及国际商业合作伙伴进行的实地核查或审计,获得中国和欧盟GMP认证。为进一步完善产能规划,复宏汉霖亦于上海市松江区投资设立生物医药产业化基地,其中松江基地(一)规划建设产能24,000L,目前已开始进行临床样品的GMP生产;松江基地(二)占地面积约200亩,建成后将成为国内大型生物医药生产基地,全面投入运营后可满足逾20款产品同时生产。基地严格按照国际GMP标准设计,充分应用一次性生产技术、连续流生产技术等国际新技术,现已完成主要生产楼的结构封顶工作。
【主要业绩与成绩】
一、生物类似药打下坚实基础
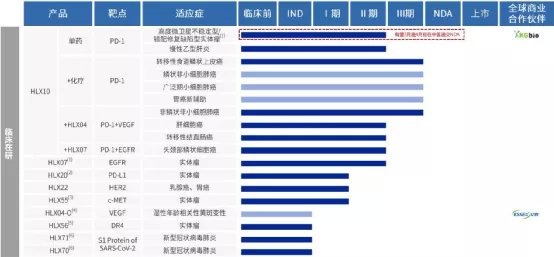
(一)三款重磅生物类似药具备强大竞争力-汉立康(利妥昔单抗)、汉曲优(曲妥珠单抗)、汉达远(阿达木单抗)凭借先发和销售优势有望成为市场领导者
(二)生产优势带来成本优势-迅速扩大的产能及先进工艺的采用,不断降低生产成本
(三)中欧认证的国际质量标准-背书“汉霖品质”,为海外市场扩张打下坚实基础(四)积极应对集采政策-短期之内预计不会对HLX01及HLX02产品产生重大影响,HLX03及HLX04产品将凭借成本优势积极应对
二、PD-1(HLX10,斯鲁利单抗)进入收获期凸显差异化及联合治疗优势(一)PD-1进入收获期-MSI-H、鳞状非小细胞肺癌等众多适应症从2021年开始陆续申报NDA(二)联合治疗优势-HLX10+HLX04(PD-1+VEGF)治疗非鳞非小细胞肺癌、肝癌;HLX10+HLX07(PD-1+EGFR)治疗头颈鳞癌(三)差异化优势-胃癌新辅、MSI-H等(四)布局创新药出海-PD-1多个国际多中心临床(鳞状非小、小细胞肺癌等)为创新药出海做好准备
三、自研+BD加速多远创新(一)优化创新管线,提升创新质量和效率-优化研发资源配置,加速推进部分优质资产(临床早期:EGFR、HER2等;临床前:CD47、TIGIT/PD-L1等)(二)BD引入更多优质资产-快速引入国际优质创新药有利补充汉霖自身创新管线(单抗、双抗、小分子、ADC等)
【在研项目概况】


【企业介绍】
再鼎医药是一家立足中国、全球运营的创新型生物制药公司,致力于为中国及全球的患者提供癌症、自体免疫及感染性疾病领域的创新药物。总部位于上海,自2014年成立以来,已与多个全球领先的生物制药公司建立了合作伙伴关系,打造起广泛的后期创新候选药物产品线。对于寻求进入中国市场以及寻找国际临床开发长期战略合作伙伴的全球生物制药公司来说,再鼎医药凭借一系列成功合作案例,成为了业界最值得信赖的合作伙伴人选之一。通过这些成功合作,再鼎医药打造起中国创新生物技术公司中最强大的晚期肿瘤产品管线,拥有多个全球同类首个和/或同类最佳药物。同时公司正在不断提高内部研发能力,以进一步补充公司的产品线,目标是未来每年可以有1-2个全球新药临床试验申请(IND)。
【主要业绩与成绩】
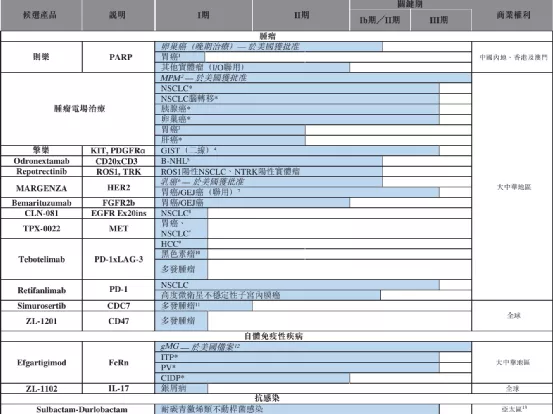
一、则乐(尼拉帕利)于2020年9月,第2个适应症获批,用于对一线含铂化疗完全或部分缓解的卵巢癌成人患者的维持治疗,随后该产品于2020年12月进入医保目录。
二、肿瘤电场治疗仪爱普盾于2020年6月获批上市,用于与替莫唑胺联用治疗新诊断的胶质母细胞瘤(GBM),以及作为单一疗法用于复发胶质母细胞瘤患者的治疗。
三、酪氨酸激酶抑制剂(TKI)擎乐(瑞派替尼)2020年8月,用于治疗四线GIST的新药上市申请获国家药监局授予优先审评资格,预计该申请将于2021年上半年获批准。
四、重大授权及战略合作协议:
(1)于2020年7月,与TurningPoint订立独家授权协议,据此,TurningPoint独家授权公司在大中华地区开发及商业化包括repotrectinib(作为一种活性成分)的产品用于所有人类治疗适应症。
(2)于2020年12月,与CullinanPearl(CullinanManagement,Inc.(前称CullinanOncology,LLC)的附属公司,或Cullinan)订立授权协议,据此,Cullinan的若干专利及专业技术项下的独家授权,以于大中华地区开发、製造及商业化包括CLN-081(作为一种活性成分)的产品用于所有人类及动物用途。
(3)于2020年4月,与RegeneronIrelandDesignatedActivityCompany(Regeneron的联属公司)订立合作协议,据此,获得包括odronextamab(作为唯一活性成分)的产品在大中华地区的肿瘤学开发及独家商业化权利。
【在研项目概况】

【企业介绍】
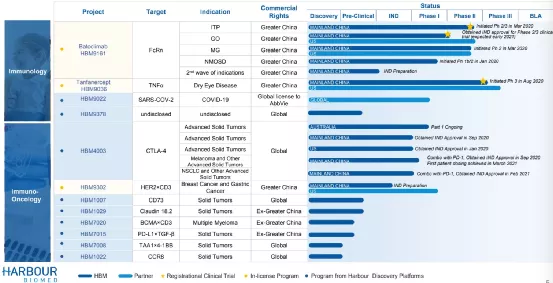
HarborBioMed是一家全球临床阶段生物制药公司,致力于在肿瘤学和免疫疾病领域中发现,开发和商业化新型抗体疗法,以满足未满足的患者需求。公司正在使用集成的Harbor抗体平台构建强大的产品线,这使公司能够开发出具有强大效力和安全性的针对各种疾病靶标的高度分化抗体。公司专有码头小鼠®生成在古典两条重链和两条轻链(H2L2)格式仅有重链(HCAB)格式的完全人单克隆抗体。基于公司的HCAb抗体,基于HCAb的免疫细胞接合剂(HBICETM)能够提供联合疗法无法实现的肿瘤杀伤作用。与公司的单个B细胞克隆平台集成后,公司的抗体发现引擎在开发下一代治疗性抗体方面具有极高的独特性和效率。
【主要业绩与成绩】
一、DiscoveryAdvancement(一)3Monoclona lAntibodies:including HBM 1022(CCR8), HBM1007(CD73) and HBM1029(Claudin18.2)(二)3Bispecific Antibodies:including HBM7008(TAA1×4-1BB),HBM7015(PD-L1×TGFβ)and HBM7020(BCMA×CD3)(三)1Co-Discovery:HBM9378Clinical Progress
二、ClinicalProgress(一)6ClinicalTrials: including HBM9161 ITP, MG, NMOSD; HBM9036DED; HBM4003 monoin Australia and combowith PD-1in China(二)7IND Approvals:including 4 for HBM4003, 2 for HBM9161 and 1for HBM 9022(三)1Breakthrough Therapy Designation:HBM 9161 MG
三、GlobalCollaboration Financial Strength(一)COVID-19Neutralizing AntibodyOut-license(二)StrategicCo-Development& Out-license Collaboration(三)StrategicCo-DiscoveryCollaboration
【在研项目概况】

【企业介绍】
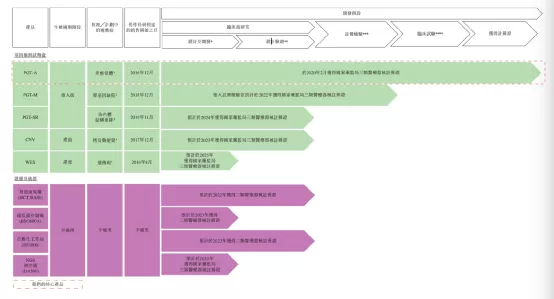
苏州贝康医疗股份有限公司作为NGS细分市场—生殖领域的领军龙头企业,致力于高通量测序技术在生育健康领域的研发和临床应用,是苏州市“独角兽”培育企业,B3楼拥有1364㎡的生产中心,A3楼拥有6271㎡的研究中心。公司自成立以来一直秉承着“做合规产品”的理念,坚持走合规化研发、注册、报证的道路。2015年,公司申报国家标管中心将PGT-A试剂盒界定为“三类医疗器械”进行监管;2016年,该试剂盒成功获得“国家创新医疗器械特别审批”进入临床试验;2017年,公司参与制定PGT-A质量控制评价指南,填补了我国三代试管婴儿质量控制技术标准的空白;同年,公司建成符合法规及GMP要求的标准洁净生产车间并通过省医检所检测。2019年,公司完成三代试管PGT-A临床试验大数据验证;2020年2月21日,该产品获国家药监局批准上市,标志着我国三代试管婴儿技术进入医疗器械监管的有证时代,填补了国内空白。2021年2月8日,贝康医疗成功登录香港主板,成为中国辅助生殖基因测序产业NGS第一股。
【主要业绩与成绩】
一、于2021年2月,与PGT-SR试剂盒相关的自主研发专利(一种核酸文库构建方法及其在植入前胚胎染色体结构异常分析中的应用)已于国家知识产权局注册。
二、于2021年3月4日,本公司与苏州工业园区规划建设委员会订立确认书,以总代价人民币7,960,000元中标位于中国江苏苏州工业园区星塘街以东,江韵路以北、作工业用途的一片土地(总地盘面积为21,626.14平方米)的土地使用权。
三、于2021年3月6日,本公司与苏州超云生命智能产业研究院有限公司(「苏州超云」)订立研究成果转化合作协议(「合作协议」)。根据合作协议,苏州超云同意就遗传病诊断及遗传谘询的人工智能技术应用提供学术研究服务,而本公司同意基于苏州超云的学术研究成果及知识产权,利用自身丰富的行业经验提供产品开发服务。
四、于2021年3月8日,本公司根据超额配股权按发售价每股H股27.36港元成功发行及配发额外6,859,000股H股本公司普通股。
【在研项目概况】

【企业介绍】
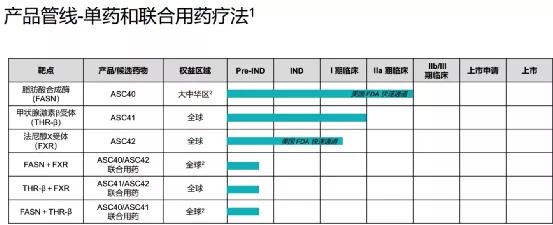
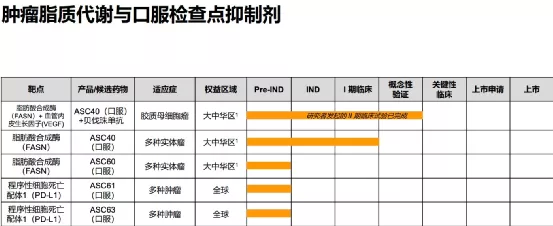
歌礼成立于2013年,2018年在香港证券交易所上市(01672)。歌礼专注于非酒精性脂肪性肝炎(NASH)、肿瘤脂质代谢与口服检查点抑制剂、病毒性肝炎和艾滋病四大疾病领域创新药的研发和商业化,满足国内外患者未被满足的临床需求。甘莱制药有限公司为歌礼制药集团旗下全资子公司,专注于NASH疾病领域创新药的研发和商业化。
【主要业绩与成绩】本集团在非酒精性脂肪性肝炎管线三款分别针对三个互补靶点(FASN、THR-β及FXR)的全球首创或同类最佳的管线和三个靶点对应的、互补的三种联合用药疗法上取得了重大进展。
截至本公告日期,本集团有两项临床试验申请(ASC41和ASC42)获得美国食品药品监督管理局批准;一项临床试验申请(ASC41)获得国家药品监督管理局批准;两项美国食品药品监督管理局授予的快速通道资格认定(ASC42和ASC40)。本集团已完成四项I/Ib期临床试验(三项ASC41试验和一项ASC40试验)及一项II期临床试验(ASC40)。
【在研项目概况】
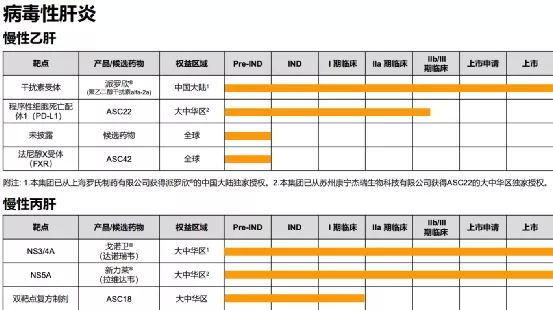

【企业介绍】
东曜药业是一家研发药品进入临床阶段的生物制药公司,专注于创新型肿瘤药物及疗法的开发及商业化。公司力求打造患者、家属及医疗专业人士信赖的肿瘤治疗领先品牌。目前,公司拥有针对多种癌症的在研药物组合,包括单克隆抗体药物、抗体偶联药物(ADC)、溶瘤病毒药物及特殊抗肿瘤药物(如脂质体药物)。自2009年成立以来,公司已建立起一个集合药物发现、产品开发、临床前及临床开发、商业化生产和营销于一体的综合性平台,为公司在创新药物产业价值链中开展业务提供灵活性及可扩充性。
【主要业绩与成绩】一、Milestones of product in clinical phases(一)TAB008:submitted the drug launch application, completedtheon-siteverification, and released the results of phase III clinical research(二)T0Z309:completedtheon-siteverification(三)TAA013:started phase III clinical trial and has been recruiting successfully(四)TAB014:Phase III clinical trial is approved by FDA
二、Layout of Commercial production(一)Production workshop for ADC commercial drug substance was put into operation(二)Manufactured multiple batches of ADC drugs for clinical use(三)The production base of mAb drugs and chemical drugs have passed the on-site verification of GMP compliance
三、Innovative drug development(一)Developed innovative targeted biological drugs incooperation with Harbour BioMed(二)Independently developed innovative targeted ADC drugs
四、CDMO/CMO business(一)Reached longterm cooperation agreements with several innovative drug and biological companies(二)Anumber of CDMO/CMO projects form Abdrugs, ADC drugs and small molecule drugs were in progress ,including the cooperation with Kintor in the global clinical supplies manufacture for COVID-19
【在研项目概况】
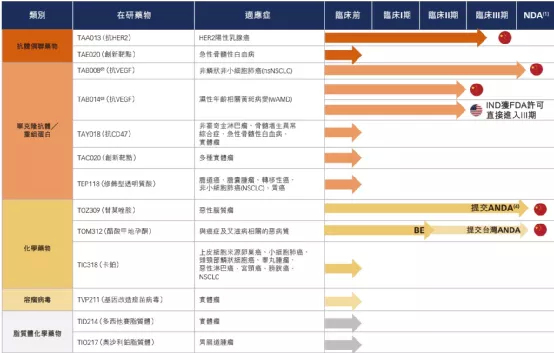

【企业介绍】
康希诺生物股份公司于2009年注册于天津滨海新区,是由跨国制药企业高管团队回国创立的国家级高新技术企业。康希诺生物以在世界范围内提供预防传染病和感染病的解决方案为己任,专业从事高质量人用疫苗的研发、生产和商业化,是国内领先的高科技生物制品企业。2019年3月,康希诺生物在香港联交所主板H股上市;2020年8月13日,康希诺生物正式登陆科创版,成为科创板开板以来首只“A+H”疫苗股。
康希诺生物的研发团队汇聚了多位曾经在赛诺菲巴斯德、阿斯利康和惠氏(现为辉瑞)等全球大型制药公司,领导创新国际疫苗研发的知名科学家和疫苗行业资深专家,建立了基于腺病毒载体疫苗技术、蛋白结构设计和重组技术、结合技术和制剂技术等四大核心技术平台,拥有多项疫苗核心知识产权及专有技术,建立了针对13个疾病领域的16种创新疫苗产品的研发管线,涵盖了对新型冠状病毒肺炎、埃博拉病毒病、结核病、脑膜炎、百白破、带状疱疹等一系列疾病的预防。
【主要业绩与成绩】
一、Ad5-nCoV的临床试验、军队特需药品批件、紧急使用授权及附条件上市许可
二、与辉瑞推广MCV4产品曼海欣®
三、本公司于2020年上半年完成婴幼儿用DTcP、DTcP加强疫苗、PCV13i的I期临床试验入组及PBPV的Ia期临床试验入组,并于2020年完成婴幼儿用DTcP、DTcP加强疫苗、PCV13i各自的I期临床试验及PBPV的Ia期临床试验。
四、于2020年6月29日,食品药品审核查验中心宣佈对MCV2新药申请许可证进行现场检查的通知。截至目前,本公司已通过现场检查。
五、于2020年9月2日,食品药品审核查验中心宣佈对MCV4新药申请许可证进行现场检查的通知。截至目前,本公司已通过现场检查。
六、完成A股发行
【在研项目概况】
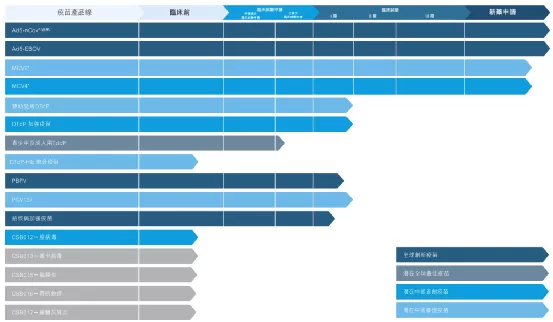

【企业介绍】
亚盛医药是一家立足中国、面向全球的处于临床开发阶段的原创新药研发企业,致力于在肿瘤、乙肝及与衰老相关的疾病等治疗领域开发创新药物。2019年10月28日,亚盛医药在香港联交所主板挂牌上市,股票代码:06855。亚盛医药拥有自主构建的蛋白-蛋白相互作用靶向药物设计平台,处于细胞凋亡通路新药研发的全球最前沿。
公司已建立拥有8个已进入临床开发阶段的1类小分子新药产品管线,包括抑制Bcl-2、IAP或MDM2-p53等细胞凋亡路径关键蛋白的抑制剂;新一代针对癌症治疗中出现的激酶突变体的抑制剂等,为全球唯一在细胞凋亡路径关键蛋白领域均有临床开发品种的创新公司。
目前正在中国、美国及澳大利亚开展40多项I/II期临床试验。用于治疗耐药性慢性髓性白血病的核心品种HQP1351已在中国递交新药上市申请,该品种获得了美国FDA审评快速通道及孤儿药认证资格。截至目前,公司共有4个在研新药获得10项FDA孤儿药资格认证。
【主要业绩与成绩】
一、在中国递交HQP1351的新药上市申请,并被CDE纳入优先审评,被纳入“突破性治疗品种”
二、APG-2575在复发/难治r/rCLL中达到临床概念验证
三、APG2575在全球开展13项Ib/II期临床试验(CLL,AML,MM等);首次在欧洲开展临床试验
四、从美国FDA获得11项孤儿药资格认定,1项快速审评资格认定
五、与阿斯利康、默沙东达成2项国际临床合作
【在研项目概况】
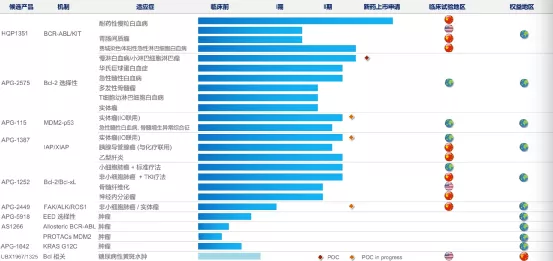

【企业介绍】
嘉和生物药业为一间实力雄厚的生物制药公司,专注于肿瘤及自身免疫药物的研发及商业化。嘉和已成功研发出靶向通路且极具潜力的候选药物,涵盖全球前三大肿瘤靶标及十款畅销药物中的五款。嘉和主要凭借内部能力建立由15款靶向候选药物组成的产品管线,该等药物在中国具有巨大的商业潜力,涵盖已知及新型生物学通路。嘉和的管理团队成员平均拥有逾15年行业经验,往绩记录优良,专长组合均衡。公司在中国设立了三大办事处及产业基地——上海张江、云南玉溪和北京办公室,并在美国南旧金山创立了实验室,目前拥有约400名员工,其中80%为科研与临床人员。
【主要业绩与成绩】
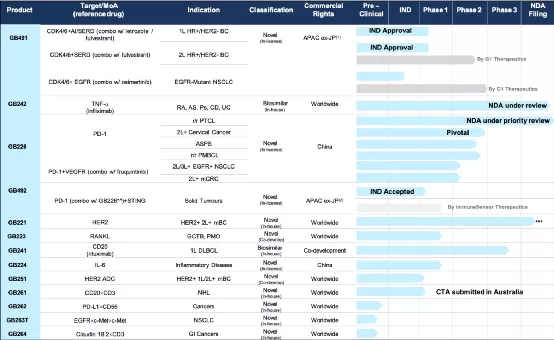
一、NDA/BLA Progress(一)Two NDA/BLA have been filed and currently under review by NMPA1、GB226(PD-1)Priority Review for PTCL2、GB242(Infliximab Bio similar) UnderReview二、Clinical Development(一)Three registrational pivotal trials completed(二)GB491(CDK4/6)for 1Land2 Lphase1bHR+/HER2-breast cancer bridging studies ECapproved(三)GB26 1 first in human(FIH)trial EC submitted in Australiain March-21
三、INDProgress(一)Eight IND applications approved and two under reviews(二)Three Bi specificas sets entering into IND enabling stage
四、Commercialization(一)Key commercial personnel sonboard preparing for the new drug launch(二)Participated in 2020 annual conference of CCPTL to promote Genorand GB226(三)Investment agreement with China(Shanghai) Pilot FreeTrad e Zone Lin-Gang Special Area Administration
五、Active BD(一)In-licensed GB491(CDK4/6) for the treatment of HR+/HER2-breast cancer from G1The rapeutics(二)In-licensed GB492(STINGagonist) from Immune Sensor Therapeutics
六、Success Financing(一)Received B-roundfinancing of US$ 160mn in May(二)Successfully raised US$400 mn and listed on the main board of HKEX in October
【在研项目概况】

【企业介绍】
诺诚健华医药有限公司是一家处于临床阶段的生物医药公司。公司致力于发现、开发及商业化同类最佳及、或首创的用於治疗癌症及自身免疫性疾病的药物。本集团由公司的董事崔霁松博士及施一公博士透过个人提供资金及注资共同创办。
【主要业绩与成绩】
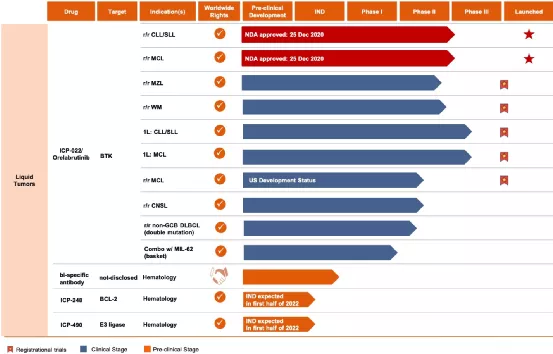
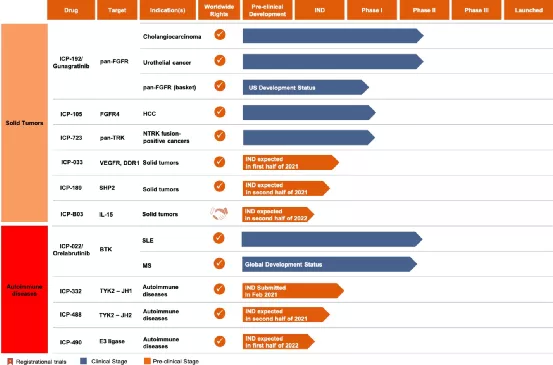
一、COMMERCIALIZATION
(一)Launch of Orelabrutinib First Commercial Product1、NMP Ahasgrantedmarketapprovalon25December2020(二)CommercialTeamandRapidPenetration1、Over 150 experienced sales and marketing members2、First prescriptionon Jan13,2021,within 2 weeks of approval3、Rapid penetration to cover 230 cities,870 hospitals and 4,000 doctors(三)BD Team Buildup1、In October 2020,InnoCare appointed Dr.Manish TandonasVP of Business Development of urther strengthen the Company’sBD capabilities
二、RESEARCHANDDEVELOPMENT
(一)RapidExpansionofProductPortfolio
1、5 Registrational Trials On going PhaseII trialfor r/rWM(1)Phase II trial for r/rMZL(2)PhaseIII trial for Orelabrutinibasa first-linetreatment forCLL/SLL(3)PhaseIII trial of Orelabrutinibin combination with R-CHO Pasa first-line treatment for MCL(4)PhaseII study for r/rMCL in the US2、4 Clinical Stage Assets with15+Trials Ongoing Globally(1)MS:PhaseIIinitiated (Global trial in the U.S.,Europeand China,etc.)with huge market potential3、8 IND Enabling Stage Candidates(1)3 newly disclosed molecule–ICP-248,ICP488andICP-033(2)2 biological molecules internalized through collaboration(3)1 IND submission in1Q2021–ICP-332(4)3-4more to INDs to be submitted in the remainder of 2021
【在研项目概况】

【企业介绍】
本公司于2017年7月由CBC集团创立,而CBC集团为一家医疗私募股权公司,在制药、生物科技、医疗技术及医疗服务方面拥有多样化被投资公司组合。已打造一个由八款极具前景的临床候选药物组成的产品组合,有关药物覆盖肿瘤、免疫学、心肾疾病及感染性疾病。公司以该四个治疗领域为目标乃基于该等领域有大量未得到满足的医疗需要、病人人数众多,以及全球可用的创新产品。公司在欧美四个城市设有见识广阔及经验丰富的业务开发团队。
【主要业绩与成绩】
一、Sacituzumabgovitecan-hziy(TrodelvyTM)为公司肿瘤治疗领域中的支柱候选药物,是同类首创的TROP-2靶向抗体药物偶联物(「ADC」)产品。Sacituzumabgovitecan-hziy用于治疗转移性三阴性乳腺癌(「mTNBC」)的新药上市申请(「NDA」)已于2021年1月在新加坡提交,并且获得新加坡卫生科学局(「HSA」)受理。
二、在中国针对mTNBC进行的sacituzumabgovitecan-hziy2b期注册性临床试验已于2020年11月展开,且目前仍在进行中。
三、已于2020年12月展开3期亚洲区研究,旨在评估及比较sacituzumabgovitecan-hziy相对于医生选择疗法(「医生选择疗法」)在治疗曾接受至少两种既往化疗方案治疗失败的激素受体阳性、HER2阴性转移性乳腺癌(「HR+/HER2-mBC」)亚洲患者中的有效性及安全性,且目前仍在进行中。
四、TROPiCS-04,即sacituzumabgovitecan-hziy用于治疗转移性尿路上皮癌(「mUC」)的全球3期注册性临床试验的临床试验申请(「临床试验申请」),已于2021年1月获中国国家药品监督管理局(「国家药监局」)批准。
五、Nefecon为公司心肾治疗领域中的支柱候选药物,是开发用于治疗IgA肾病(「IgAN」)的布地奈德新型口服製剂产品。2020年12月,国家药监局药品评审中心(「药品评审中心」)授予Nefecon为用于治疗IgAN的突破性治疗品种(「突破性治疗品种」)。
六、依拉环素(XeravaTM)是一种新型全合成氟环素静脉抗生素,是为治疗多种耐药性(「MDR」)感染(包括MDR革兰氏阴性感染)一线经验单药治疗而开发的产品。‧中国国家药监局已于2021年3月受理依拉环素在中国用于治疗複杂性腹腔内感染(「cIAI」)的NDA。
【在研项目概况】


【企业介绍】
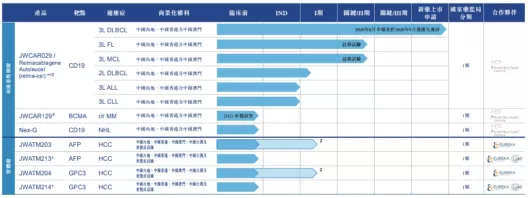
药明巨诺是一家领先的细胞免疫治疗公司,由巨诺医疗(一家百时美施贵宝的公司)和药明康德联合创建。公司已建立了一个专注为血液及实体瘤开发、制造和商业化的突破性细胞免疫疗法的一体化平台。致力于为中国市场开发创新的细胞治疗手段,改变中国患者的癌症治疗方式。公司已建立了涵盖血液及实体瘤的全面且差异化的细胞治疗产品管线。主打产品瑞基奥仑赛注射液是针对复发或难治B细胞淋巴瘤的靶向CD19的CAR-T疗法,有望成为中国首个获批1类生物制品的CAR-T疗法。
【主要业绩与成绩】
一、2020年6月,公司于苏州新建的商业化生产基地自江苏省有关部门获得药品生产许可证。该基地佔地约10,000平方米,按cGMP及QMS标准进行商业及临床製造。该基地设置四大独立的功能模块。该等模块的设计可支持所有细胞平台,包括使用基因改造的自体T细胞及NK细胞、基因改造或非基因改造的肿瘤浸润淋巴细胞及基因改造的同种异体免疫细胞的平台,以及生产临床级别的用于细胞基因改造的病毒载体的设施。目前,两个模块已建成投产,通过资质认定且全面按照GMP标准运营。公司的生产基地,可满足每年最多2,500例自体CAR-T细胞治疗的产能需求。
二、于2020年1月,公司与Acepodia订立选择权及许可协议,据此,Acepodia授予公司选择权以于中国内地、中国香港及中国澳门开发、生产及商业化两种Acepodia产品的独家许可。该等Acepodia产品中有一种公司称作JWACE002,是一种靶向HER2的新型同种异体自然杀伤细胞产品,用于治疗子宫内膜癌、卵巢癌、乳腺癌及胃癌。
三、香港联交所上市及首次公开发售(「首次公开发售」)
【在研项目概况】

【企业介绍】
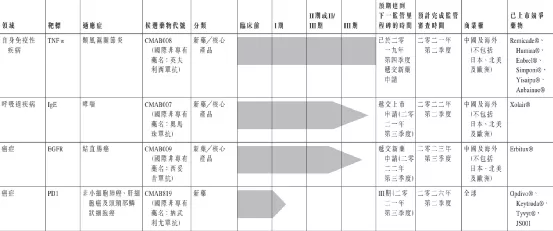
迈博药业有限公司是中国领先的生物医药公司,专注于治疗癌症和自身免疫性疾病的新药及生物类似药的研发和生产。致力于透过公司高效的研发体系以及低成本药品生产能力为市场带来高质量且可负担的创新型生物药品,并充分利用自身丰富的研发经验开发多种治疗产品。泰州药业生产基地有两栋楼宇,每栋佔地15,000平方米,存放公司的单抗体生产设施。
目前,公司的候选药物管线目前包括9个单克隆抗体药物,其中3个为处于III期临床试验的核心产品:CMAB007(奥马珠单抗)、CMAB009(西妥昔单抗)和CMAB008(英夫利昔单抗)。此外,公司其他两种候选药物CMAB809(曲妥珠单抗)和CMAB819(纳武单抗)已获批准进行临床试验。
【主要业绩与成绩】
一、公司已于二零二零年大体完成在泰州新建三条生产线,将公司的细胞反应器总规模增至18,000升。公司亦已大体完成在公司位于泰州的新研发工业基地的厂房建设,预期公司的细胞反应器总规模将于二零二二年进一步增至40,000升。公司在抗体药物製备领域拥有坚实的设备、技术及质量基础,将令公司在未来的医保集採谈判中享有卓越的竞争优势。
二、CMAB008(英夫利西單抗)目前,公司预期CMAB008将于二零二一年第二季度末前后取得国家药监局的上市批准。报告期内,公司已完成与现已上市的英夫利西单抗产品相对的头对头研究,以确认CMAB008的类似药代动力学特徵及免疫原性(「注射用CMAB008与类克在健康男性志愿者的随机、双盲、平行对照、单次给药药代动力学、安全性和免疫原性的I期比对研究CTR20200314」)。公司预期,CMAB008有望被批准面向多种适应症(具体为:(i)类风湿关节炎、(ii)成人及儿童克罗恩病、(iii)瘘管性克罗恩病、(iv)强直性脊柱炎、(v)银屑病及(vi)成人溃疡性结肠炎),亦有望进入医保目录。现时公司预期CMAB008或于二零二一年第二季度末前后获国家药监局批准上市。
三、CMAB007(奧馬珠單抗)报告期内,CMAB007正在实施用于治疗过敏性哮喘的III期临床试验,截至二零二零年十二月三十一日,公司处于临床试验收尾阶段。呼吸系统疾病SARS-CoV-2肺炎的爆发及最近北京和东北地区疫情的反弹对公司二零二零年的研究工作产生了一定影响,基于国家药监局就生物新药新的法规和技术指引,公司正在实施一个与现已上市的奥马珠单抗产品相对的头对头I期比对研究,以确认CMAB007的类似药代动力学特徵及免疫原性,预期CMAB007未来有望拓展适应症到慢性特发性荨麻疹及季节性过敏性鼻炎。公司预期待所有病例完成临床用药观察及数据分析后,于二零二一年第三季度向国家药监局提交药物上市申请。公司目前预计CMAB007可以在二零二二年第二季度获国家药监局批准上市。
四、CMAB009(西妥昔单抗)报告期内,CMAB009正在实施用于治疗结直肠癌的III期临床试验。呼吸系统疾病SARS-CoV-2肺炎的爆发及近期北京和东北地区疫情的反弹对公司二零二零年的研究工作产生一定影响,公司预期待所有病例完成临床用药观察及数据分析后,将于二零二二年第三季度向国家药监局提交新药上市申请。公司亦在准备实施CMAB009其他适应症的临床试验。公司目前预计CMAB009可以在二零二三年第三季度获国家药监局批准上市。
【在研项目概况】

【企业介绍】
华领医药技术(上海)有限公司是一家立足中国、放眼世界的生物技术公司,2011年落户上海张江,2018年在香港上市。华领医药是全球第一家实现血糖传感器葡萄糖激酶激活剂(GKA)临床开发的公司,并建立了“修复传感、重塑稳态,从根本上治疗糖尿病”的技术标准和临床用药方案,实现了全球首创糖尿病新药在中国“从0到1”的突破。
【主要业绩与成绩】
一、临床试验
(一)完成SEED(HMM0301)在中国的首项III期注册试验,研究dorzagliatin单药疗法对2型糖尿病(T2D)未用药患者的疗效及安全性,并宣佈首个52週研究正面结果,展现持续疗效、良好安全性及耐受性
(二)完成DAWN(HMM0302)在中国的第二项III期注册试验,研究dorzagliatin对二甲双胍足量治疗失效的T2D患者的疗效及安全性,并宣佈首个24週及52週研究正面结果,展现持续疗效、良好安全性及耐受性
(三)于美国糖尿病协会(ADA)第80届科学年会上报告单药治疗临床试验SEED的24週数据,显示β细胞功能大幅改善及餐后两小时血糖值降低。于中华医学会糖尿病学分会2020年学术会议上报告DAWN的其他数据,显示β细胞功能改善及胰岛素抵抗指标下跌
(四)完成HMM0110,在终末期肾功能损伤患者中表现出良好的药代动力学结果,支持dorzagliatin(无需剂量调整)潜在应用于患有中度、重度和终末期慢性肾病(即CKD3-5期)的T2D患者
(五)完成HMM0111,一项dorzagliatin或西格列汀(一种DPP-4抑制剂)单独用药或两者联合用药的药代动力学(PK)和药效学(PD)参数研究,dorzagliatin和西格列汀联合用药通过调控GLP-1分泌,对T2D患者在降低血糖及改善β细胞功能的疗效方面显示出明显增效作用
(六)完成HMM0112,一项dorzagliatin及恩格列淨(一种SGLT-2抑制剂)单药或两者联合用药的PK和PD特点研究,dorzagliatin及恩格列淨联合用药在降低血糖及改善β细胞功能的疗效方面显示出明显增效作用
二、商务合作(一)与拜耳医药保健有限公司在中国内地达成商业合作协定和战略合作(二)与浙江瑞博製药(作为现有生产合作伙伴的额外供应商)订立商业供应协议(三)上海市药品监督管理局授予在中国的dorzagliatin药品生产许可证(四)宣佈正式于上海设立张江科学城的全球营运总部及研发中心
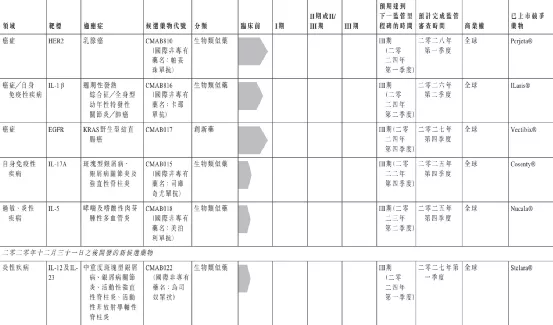
【在研项目概况】


【企业介绍】
中国抗体制药有限公司专注于研究、发展、制造及商业化免疫性疾病疗法,主要研制以单克隆抗体为基础的生物药。公司注重科技研发,其旗舰产品SM03为全球首项用以治疗类风湿关节炎的潜在抗CD22单抗,已在中国进入类风湿关节炎三期临床试验,并被列入国家十三五重大新药创制专项重大项目。此外还有多个同类靶点首创(First-in-target)及同类首创(First-in-class)潜在在研药物,部分已处于临床阶段,适应症覆盖类风湿性关节炎、系统性红斑狼疮、非霍奇金氏淋巴瘤、哮喘等具有重大未满足临床需求的疾病。
【主要业绩与成绩】
一、公司的旗舰产品SM03-截至报告期末,SM03类风湿关节炎(「RA」)的III期临床试验已招募合共332名患者,公司预期最早于二零二一年上半年内完成患者招募。SM03的III期临床试验的安全数据之中期分析已于二零二零年六月完成,该分析结果大致上与SM03II期临床试验结果保持一致。
二、公司的主要产品SN1011-SN1011的新药研究(「IND」)(针对自身免疫性疾病)申请已于二零二零年八月二十七日获中华人民共和国(「中国」)国家药品监督管理局(「国家药监局」)批准。本公司已于二零二一年一月十五日在中国上海进行的SN1011I期临床试验中成功为首位健康受试者给药。截至本公告日期,SN1011的I期临床试验已有27名受试者入组。公司预计于二零二一年上半年完成I期临床研究,其后于二零二一年下半年启动系统性红斑狼疮(「SLE」)的II期临床研究。
三、另一项主要产品SM17-SM17的IND申报准备已完成。公司正为将于二零二一年第三季度作全球性IND申请彙编档案文件。
四、商业化生产基地—本集团于二零二零年六月二十四日购买苏州独墅湖高等教育区一幅地块以兴建公司的中国总部、研发中心及另一个重要生产基地。该项目涉及的地盘面积为43,158平方米,总楼面面积约70,000平方米。于竣工后,该生产基地的产能将超过30,000升。建筑工程正稳步进行中,且预计于二零二二年年末竣工。
五、探索创新型药物靶点识别—于二零二零年七月二十二日,本公司就创新型药物靶点识别与D2M达成长期合作关係而订立研究、开发及商业化协议。根据此次合作,本公司有权就本公司根据优先靶点甄选机制得出的D2M靶点识别工作的初始结果而选择的合资格药物靶点进行后续研究、开发及商业化。
【在研项目概况】


【企业介绍】
康方生物是一家致力于研究、开发、生产及商业化全球病人可负担的创新抗体新药的生物制药公司。公司于2020年4月24日正式在香港联合交易所有限公司主板挂牌上市。自成立以来,公司建立了端对端全方位的药物开发平台(ACE平台)和体系,涵盖了全面一体化的药物发现和开发功能,包括靶点验证、抗体发现与开发、CMC生产工艺开发和符合GMP标准的规模化生产。公司也成功开发了双特异抗体药物开发技术(Tetrabody技术)。公司目前拥有20个以上用于治疗肿瘤、自身免疫、炎症、代谢疾病等重大疾病的创新药物产品管线,9个品种进入临床研究,包括两个国际首创的双特异性抗体新药(PD-1/CTLA-4以及PD-1/VEGF)。康方生物期望通过高效及突破性的研发创新开发国际首创及同类药物最佳疗法的新药,成为全球领先的生物制药企业。
【主要业绩与成绩】
一、PD-1/CTLA-4双特异性抗体(AK104)2020年12月,AK104在中国治疗复发或转移性宫颈癌的注册性II期临床试验提前完成患者筛选入组
二、PD-1/VEGF双特异性抗体(AK112)2020年11月,AK112的Ia期临床研究阶段性数据在2020中国肿瘤免疫治疗会议上发布
三、CD47单克隆抗体(AK117)2020年11月,AK117首次人体临床研究进展在SITC2020上呈列
四、PD-1单克隆抗体派安普利(AK105)2020年11月,AK105治疗复发或难治性经典型霍奇金淋巴瘤和治疗二线及以上已接受化疗治疗的转移性鼻咽癌最新研究数据在SITC2020上呈列
五、CD73单克隆抗体(AK119)2020年10月,AK119用于治疗COVID-19的临床试验在新西兰完成首例健康受试者给药。
六、VEGFR-2单克隆抗体(AK109)2020年6月,AK109在中国剂量递增I期临床试验中,首例晚期实体瘤患者完成入组及给药
七、PCSK9单克隆抗体(Ebronucimab,AK102)2020年12月,AK102在中国治疗高危或极高危高胆固醇血症的IIb期临床试验完成患者入组。本公司即将在中国开展针对该适应症的III期临床试验。
八、IL-4R单克隆抗体(AK120)2020年12月,AK120获得FDA允许在美国开展治疗中重度特应性皮炎的Ib期临床试验
九、IL-12/IL-23单克隆抗体(AK101)2020年5月,AK101获得NMPA的中国新药临床试验申请许可,在中国开展治疗溃疡性结肠炎临床试验。此前,AK101已获得FDA批准开展治疗溃疡性结肠炎临床试验
十、IL-17单克隆抗体(AK111)2020年6月,AK111在中国的Ib期临床试验中,首例中重度银屑病完成入组及给药。
【在研项目概况】

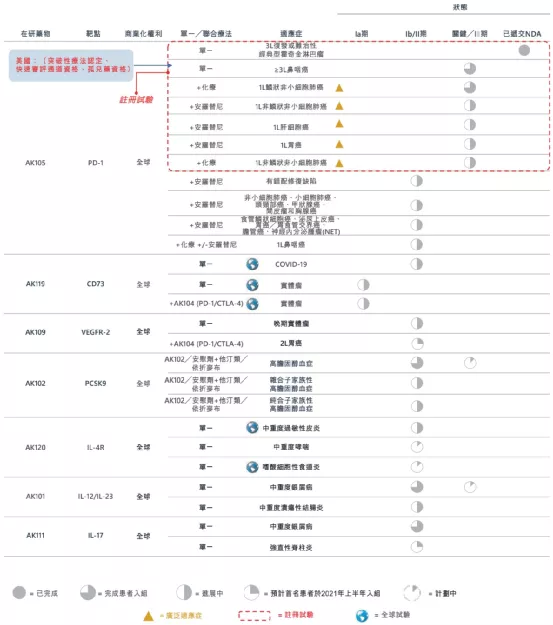

【企业介绍】
康宁杰瑞生物制药成立于2015年,专注于研发、生产和商业化创新肿瘤药物。2019年12月12日,康宁杰瑞生物制药在香港联交所主板上市。公司创建了具有自主知识产权的生物大分子药物发现、研发、生产技术平台,包括蛋白质/抗体工程平台、抗体筛选平台和多功能抗体开发平台。
【主要业绩与成绩】
一、KN046KN046已在澳大利亚及中国进行临床试验并于2020年进入关键性试验阶段。目前,有大约20项涵盖10多类肿瘤(包括NSCLC、胰腺癌、HCC、三阴乳腺癌、食管鳞状细胞癌及胸腺癌)处于多个阶段的临床试验。该等临床试验的结果已初步显示KN046具有良好安全性及可观疗效。
二、KN026于2020年12月,本公司收到国家药监局就KN026联合呱柏西利或KN026、呱柏西利和氟维司群联合疗法的IND申请批准,用于曲妥珠单抗和紫杉类药物治疗失败的HER2阳性局部晚期不可切除及╱或转移性乳腺癌患者的治疗。
三、KN035(Envafolimab)于2020年12月17日,KN035的生物製品许可申请获国家药监局受理。
四、荣誉奖项于2020年6月10日,本公司与中国科学院上海巴斯德研究所订立一份合作开发协议,内容有关用于新型冠状病毒治疗抗体的共同开发、生产及商业化。于2020年7月,本公司获认定为江苏省国际研发中心。于2020年7月,本公司董事长、执行董事兼首席执行官徐霆博士获苏州市政府授予第六届「苏州杰出人才奖」。「苏州杰出人才奖」是重要人才奖项,每三年评选一次,以奖励为经济社会发展作出重大贡献的十位获奖者。于2020年7月,本公司执行董事兼公司运营副总裁刘阳女士入选福布斯中国评选的2020年中国科技女性50强。该奖项是对科技行业女性领袖所作出的突出贡献的认可。
【在研项目概况】
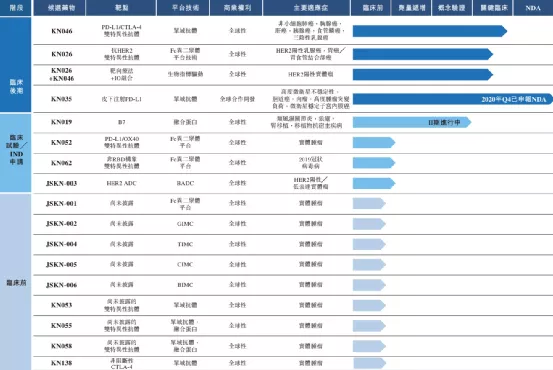

【企业介绍】
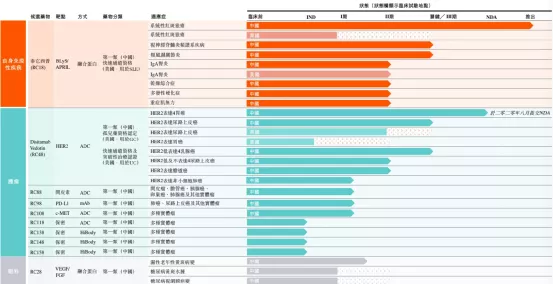
荣昌生物制药(烟台)股份有限公司由王威东先生领导的烟台荣昌制药股份有限公司和留美科学家房健民博士于2008年共同创立。荣昌生物总部位于中国山东省烟台市,在中国和美国均设有实验研究机构和办事处。荣昌生物致力于发现、开发和商业化创新的、有特色的生物药物,针对自身免疫、肿瘤、眼科等重大疾病领域创制出一批具有重大临床价值的生物新药。
【主要业绩与成绩】
一、美国食品药品监督管理局(FDA)于2020年1月批准公司在美国开展泰它西普用于治疗系统性红斑狼疮(SLE)的III期临床研究。2020年4月,FDA授予泰它西普用于治疗SLE快速通道资格,可加速在美国完成审查及可能批准的过程。
二、于2020年12月获得FDA通知,批准泰它西普可在美国进行针对免疫球蛋白A肾病(IgA肾病)适应症进行II期临床试验。此次获得在美国的临床试验许可,泰它西普可在美国免于I期临床试验直接开展IgA肾病II期临床试验。
三、向中国药监局(NMPA)提交disitamabvedotin用于治疗HER2过表达局部晚期或转移性晚期胃癌(GC)的新药申请(NDA),并于2020年8月获中国药监局接纳及纳入优先审评。
四、在美国,于2020年10月获得FDA关于disitamabvedotin针对HER2表达晚期或转移性胃癌以及胃食管结合部腺癌的试验性新药(IND)批准,2020年11月FDA还授予了disitamabvedotin胃癌以及胃食管结合部腺癌适应症快速审批通道认定。
五、2020年12月,disitimabvedotin获得NMPA授予的就治疗HER2表达晚期或转移性晚期尿路上皮癌(UC)的突破性疗法资格认定。
六、2020年4月,公司获得FDA批准针对治疗HER2表达晚期或转移性晚期尿路上皮癌(UC)进行的II期临床试验许可。2020年7月及2020年9月,FDA亦分别为disitamabvedotin治疗UC授予快速通道资格及突破性疗法认证。
七、鉴于公司已观察到disitamabvedotin对低水平HER2表达患者的初步疗效,公司获得NMPA同意在HER2低表达(IHC2+及FISH-)BC患者中启动disitamabvedotin的III期临床试验。
八、2020年11月,公司自主研发的抗体偶联药物(ADC)RC108获得NMPA颁发的药物临床试验批件,将在中国开展针对c-Met阳性晚期实体瘤的I期临床试验。
九、完成初期自身免疫疾病销售团队的组建,并开始组建一支独立的肿瘤领域的销售团队。
十、公司已于烟台的公司总部启动一个生产设施扩建项目,竣工后产能将由目前的12,000升增加至36,000升。
【在研项目概况】
参考材料:上市企业年报上市企业2020年业绩推介材料
(智通财经编辑:mz)





