当全球的目光都聚焦在抗肿瘤药物市场时,创新药赛道的其他细分领域同样也在迅速发展。其中,非酒精性脂肪性肝炎(NASH)领域的药物开发便极为火热。
作为全球最常见的慢性肝病,非酒精性脂肪性肝病(NAFLD)影响了近30%的成年人和70-80%的肥胖和糖尿病患者。近年来,其发病率的全球持续上升,加速了国内外药企对其投入和开发进度,然而至今尚未药物获批上市。
为分得这块巨大的市场蛋糕,众多公司均在此布局,即将赴美上市的拓臻生物(TERN.US)便是其一。
蛋糕虽大,无人能吃
智通财经APP了解到,非酒精性脂肪性肝病(NAFLD)包括单纯性脂肪肝、非酒精脂肪性肝炎(NASH)及NASH相关肝硬化。其中非酒精性脂肪性肝炎(NASH),又称代谢性脂肪性肝炎,是病理变化与酒精性肝炎相似但无过量饮酒史的临床综合征,主要表现为肝细胞大泡性脂肪变性伴随肝细胞损伤和炎症,是NAFLD中较严重的一种类型。
统计数据显示,全球约有3-5%的人患有NASH,且NASH或已成为继慢性丙型肝炎之后美国肝移植的第一大常见原因。医药市场调研机构evaluate Pharma曾预测,2025年全球NASH药物的市场规模可达400亿美元。
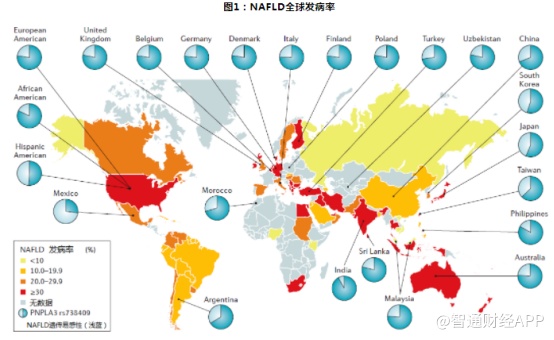
然而面对这一庞大的市场,全球各大药企却有些力不从心。目前全球范围内,针对NASH适应症已进入开发期的品种所对应的靶点有包括FXR、PXR、NRF2、PPARs、GLP-1等在内的19种靶点。然而,最高阶段已进入到临床III期的品种仅有7种。
其中,奥贝胆酸(OCA)是目前应用前景较好的一种NASH新药。作为全球第一个进入III期临床的NASH药物,OCA早在2015年1月便被FDA授予突破性药物资格,并在当年9月就正式启动III期研究。
然而在去年6月底,美国FDA却拒绝了OCA用于由NASH引起的纤维化的新药申请并在CRL中表示,认为该药物基于替代组织病理学试验终点的预期益处仍不确定,而且治疗收益并没有超过潜在的风险,因此不支持加速批准。
事实上,OCA的新药申请被拒批只是NASH新药研发崎岖道路上的冰山一角。在NASH药物研发道路上先后有Genfit、Cirius Therapeutics、诺华、吉利德和Cymabay Therapeutics等公司在此折戟。
据智通财经APP了解,NASH药物研发困难面临诸多挑战。
首先,NASH动物模型众多,但没有任何模型能够完全模拟NASH的病理特征、机制和发病历史;其次,NASH的发病机制复杂,临床表型多样,由于其与众多疾病密切相关,如代谢综合征、心血管疾病等,因此难以诊断;然后,组织学确诊NASH与疾病自然史之间的相关性目前尚缺乏临床研究数据支持,无法区分药物的治疗效果;最后,关于NASH药物临床试验的研究终点仍然没有统一。
在此背景下,拓臻生物的研发管线和研发进度便成为了投资者关注的焦点。
创新研发尚在山腰
招股书显示,通过自主研发和外部引进相结合的方式,拓臻生物现已建立了从非酒精性脂肪性肝病、脂肪变性到NASH,肝脏炎症到纤维化的全方位慢性肝病产品组合。
目前,公司研发管线中共有4种单一药物和2种联合疗法候选药物。
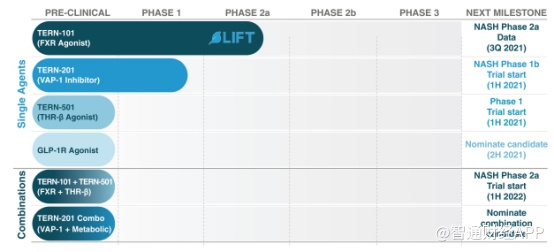
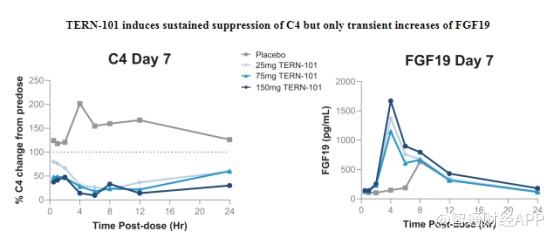
其中,临床进展较快的是FXR激动剂TERN-101,目前正在进行一项名为LIFT研究的2a期临床试验,预计该研究主要数据将在今年下半年获得。前期临床研究展示,TERN-101对肝脏FXR激活生物标志物7α-C4的显著抑制作用,且具有良好的安全性。
另一款正在进行1期临床试验的是SSAO(又称VAP-1,血管粘附蛋白-1)抑制剂TERN-201,它可通过减少氧化应激和白细胞在肝脏的聚集为NASH的治疗提供新的治疗机制。
此外,拓臻生物还在开发一种高效、选择性小分子甲状腺激素β受体(THR-β)激动剂TERN-501和一款GLP-1R小分子激动剂。其中,TERN-501预计在今年上半年开始进行1期首次人体临床试验,它可迅速降低血清胆固醇,逆转肝脏脂肪变性、改善肝脏炎症和纤维化。
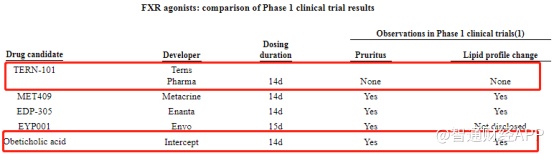
从整体的管线布局来看,目前拓臻生物最核心的候选产品莫过于TERN-101。与OCA类似,TERN-101选定的也是FXR靶点。参考OCA的临床试验数据,其在安全性方面(瘙痒和LDL升高)有着极为明显的缺陷,这也是美国FDA质疑OCA的最大原因之一。
在拓臻生物招股书中,公司对比了TERN-101与其他FXR激动剂药物的指标对比,显示出TERN-101具有相对最小的不良反应表现,对NASH患者具有较大的潜在益处。
然而从研发进度来看,目前TERN-101尚处在临床II期阶段,该药能否在后续的临床试验持续维持良好的有效性和安全性还是一个未知数。
值得一提的是,在公司的授权引进项目上,2019年6月,拓臻生物与Genfit公司达成协议,以3500万美元首付款,以及1.93亿美元的后续付款获得elafibranor在大中华区的开发和推广权益。
但在去年5月,Genfit却宣布elafibranor在对1070名2期或3期纤维化的NASH患者的的Ⅲ期对照研究RESOLVE-IT中未达到主要终点。
72周疗效数据显示,elafibranor用药组中19.2%的患者达到了NASH消退并且无纤维化加重的主要终点,而安慰剂组为14.7%。elafibranor用药组中24.5%的患者达到了纤维化改善至少一级的次要终点,而安慰剂组为22.4%。这一结果的宣布,导致Genfit股票下跌68%。
可见,针对NASH适应症的研发即使到III期临床也无法确切预知最终的结果。究其缘由,NASH并不是单一器官病症,而是系统综合征,而在该病发病和发展机理都没有明确的情况下,药物研发想从临床试验入手获得最终的疗效难度极高。因此,对拓臻生物估值进行研判,还是要看其未来能否顺利研发TERN-101及实现药物的最终获批上市。





