从6月提交新药上市申请到10月被国家药监局纳入优先审评程序,作为全球范围内少数的治疗慢性髓性白血病(CML)耐药的重磅药物,以及中国第一个三代格列卫,亚盛医药的核心候选产品奥瑞巴替尼俨然已处在上市倒计时阶段,而这也让全球血液学界对这款药物有了更多的期待。
继2019年美国血液学会年会上获得“最佳研究”提名后,今年亚盛医药携奥瑞巴替尼第三次亮相美国血液学会(ASH)年会,向全球血液学界公布了其最前沿的研发进展。
智通财经APP了解到,12月8日,亚盛医药-B(06855)宣布,公司在研原创1类新药HQP1351(拟定中文通用名:奥瑞巴替尼)的两项关键性注册 II 期临床研究结果已在第62届美国血液学会(American Society of Hematology,ASH)年会上以口头报告的形式公布,数据令人振奋。
该项临床研究的主要研究者、北京大学人民医院血液科副主任江倩教授为报告人。这是继2018、2019年之后,HQP1351的临床进展连续第三次入选ASH年会口头报告,充分显示了国际血液学界对该药物安全性和疗效的认可。
HQP1351是亚盛医药在研原创1类新药,是新型的第三代BCR-ABL酪氨酸激酶抑制剂(Tyrosine Kinase Inhibitor,TKI),用于治疗对一代、二代TKI耐药的慢性髓性白血病(CML),特别是对T315I突变的CML患者具有很好的疗效。基于两项关键性注册 II 期临床研究的结果,亚盛医药今年已在中国递HQP1351的新药上市申请(NDA),用于治疗伴有T315I突变的CML慢性期(CML-CP)及加速期(CML-AP)患者,并已被纳入优先审评。
12月7日中午12:30(美国太平洋时间),在2020 ASH会议“CML治疗的最新进展及展望”的专题讨论环节中,江倩教授作了关于HQP1351关键性注册 II 期临床研究结果的口头报告,主题为“新型BCR-ABL抑制剂HQP1351(奥瑞巴替尼)在伴有T315I突变的TKI耐药的CML患者中具有良好的疗效及耐受性:关键性注册 II 期临床研究结果”。
报告关键信息:
· HQP1351分别针对伴有T315I突变的TKI耐药的CML慢性期(CML-CP)及加速期(CML-AP)患者的两项关键性注册II 期临床试验在中国开展。患者接受HQP1351 40mg QOD治疗。
· 截至2020年3月23日,关键性注册 II 期临床研究HQP1351-CC201共纳入41例CML-CP患者,中位随访时间7.9个月。患者3个月无进展生存率(PFS)为100%,6个月PFS为96.7%,主要细胞遗传学反应(MCyR)率为75.6%,其中65.9%获得完全细胞遗传学反应(CCyR),48.8%的患者达到主要分子生物学缓解(MMR)。
· 截至2020年2月11日,关键性注册 II 期临床研究HQP1351-CC202共纳入23例CML-AP患者。中位随访时间8.2个月。患者3个月无进展生存率(PFS)为100%,6个月PFS为95.5%,主要血液学缓解(MaHR)率为78.3%,其中完全血液学缓解(CHR)率为60.9%, MCyR率为52.2%,其中39.1%获得CCyR,26.1%的患者达到MMR。
· 在HQP1351-CC201中最常见的3级/4级血液学治疗相关不良反应(TRAE)是血小板减少(48.8%),没有治疗相关性死亡发生。
· 在HQP1351-CC202中最常见的3级/4级血液学治疗相关不良反应(TRAE)是血小板减少(52.2%)。
In study HQP1351-CC202, the most frequent TRAE of Grade 3-4 was also thrombocytopenia (52.2%).
· 这两项研究数据显示,HQP1351在伴有T315I突变的TKI耐药的CML-CP及CML-AP患者中均具有良好的疗效及耐受性,且随着治疗时间的延长,缓解率和缓解深度会进一步增加。
江倩教授表示:“CML-CP及CML-AP患者一旦出现T315I突变,无论一代或二代TKI对这些患者都是无效的。因为目前在国内无药可医,这是一个临床需求高度未满足的领域。第三代TKI抑制剂HQP1351的两项关键性注册 II期研究数据的结果证明了该药物在伴有T315I突变的TKI耐药的CML-CP及CML-AP患者中具有良好的疗效及耐受性。我们非常期待尽快深入和全面地推进HQP1351这类本土原研创新药物的临床开发和临床研究,早日让患者受益。”
对此,亚盛医药首席医学官翟一帆博士表示:“作为第三代BCR-ABL抑制剂,HQP1351的II期研究数据展现了良好的疗效和耐受性,令人振奋。该药物的研究进展连续三次入选ASH口头报告,更是充分显示了国际血液学界对HQP1351这一潜在CML治疗药物的认可。这也是继HQP1351在中国递交NDA,并获纳入优先审评后的又一重大里程碑。我们期待HQP1351早日获批上市,从而造福中国乃至全球的耐药CML患者。”
实际上,除了全球学界以外,资本市场对于奥瑞巴替尼的落地上市同样有较高的期待。作为治疗伴有T315I突变的慢性髓性白血病(CML)的特效药,奥瑞巴替尼的未来市场潜力也预计将在其上市后转化为公司估值的真金白银。
据智通财经APP了解,从市场空间来看,奥瑞巴替尼面对的全球CML市场规模在2030年将增至58亿美元,而在中国的CML药物市场到2023年市场规模将预计增长至142亿元。
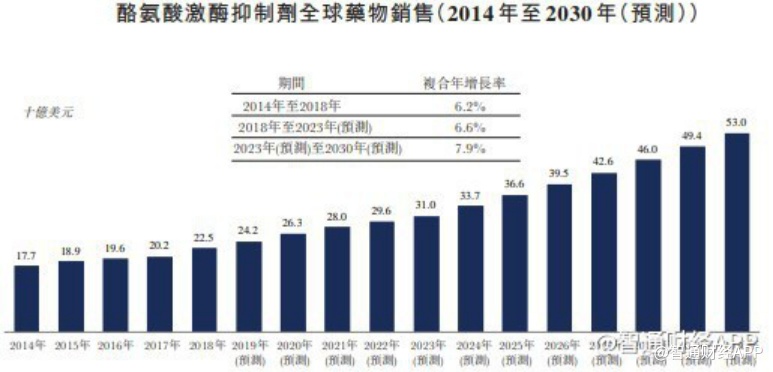
从市场竞争角度来看,目前与HQP1351存在潜在竞争关系的药物——全球首款三代TKI帕纳替尼,目前并未在中国上市。也就是说,HQP1351若成功在国内获批上市,将成为国内首款上市的第三代BCR-ABL抑制剂,市场独占性优势明显。
今年10月29日,亚盛医药获得《药品生产许可证》引发了市场的广泛关注。取得《药品生产许可证》意味着亚盛医药的质量管理体系的建立和对于未来上市药物生产的监督和管理的良好开端,为奥瑞巴替尼的上市申请与商业化生产打下坚实的基础。






