本文源自微信公众号“医药观澜”。
基因突变是驱动正常细胞癌变的关键。基于特定基因突变开发靶向疗法的思路,是新药研发领域常见做法。研究发现,FGFR基因异常大约存在于7%的各类实体瘤中,在多种癌症中的普遍存在,使其成为当下热门靶点之一。目前,强生(Johnson & Johnson)、辉瑞(Pfizer)等大型医药公司,以及诺诚健华-B(09969)、信达生物(01801)、基石药业-B(02616)、再鼎医药(ZLAB.US)、和黄医药(HCM.US)等多家中国创新药企都在进行FGFR靶向疗法的开发。
全球范围内,现已有两款FGFR抑制剂获批,它们的到来将膀胱癌和胆管癌治疗迈入了靶向治疗的新时代。同时,作为“不限癌种”靶点之一,FGFR抑制剂在肺癌、肝癌、乳腺癌等癌种的临床研究中也取得了不错的进展。未来,FGFR还有多大的潜力?

▲各类实体瘤中FGFR异常频率(图片来源:参考资料[1])
FGFR介导四个关键信号通路
成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)属于酪氨酸激酶家族的一员,包括FGFR1、FGFR2、FGFR3、FGFR4四种受体亚型。当FGFR与配体结合时,会诱导FGFR形成二聚体,并催化自身发生磷酸化,进而激活四个关键的下游信号通路:RAS-RAF-MAPK,PI3K-AKT,信号转导子和转录激活子(STAT)以及磷脂酶Cγ(PLCγ)。
由FGFR介导的信号传导通路是正常细胞生长分化所必需的,它们参与新血管生成、细胞增殖和迁移、调节器官发育、伤口愈合等生理过程。因此,FGFR基因又被称为重要的发育基因。
然而,当FGFR发生突变或者过表达时,会引起FGFR信号通路的过度激活,并进一步诱发正常细胞癌变。其中,RAS-RAF-MAPK的过度激活可刺激细胞增殖与分化;PI3K-AKT过度激活会使得细胞凋亡受抑制;SATA与促进肿瘤侵袭和转移,增强肿瘤免疫逃逸能力密切相关;PLCγ信号通路则是肿瘤细胞转移调控的重要途径。
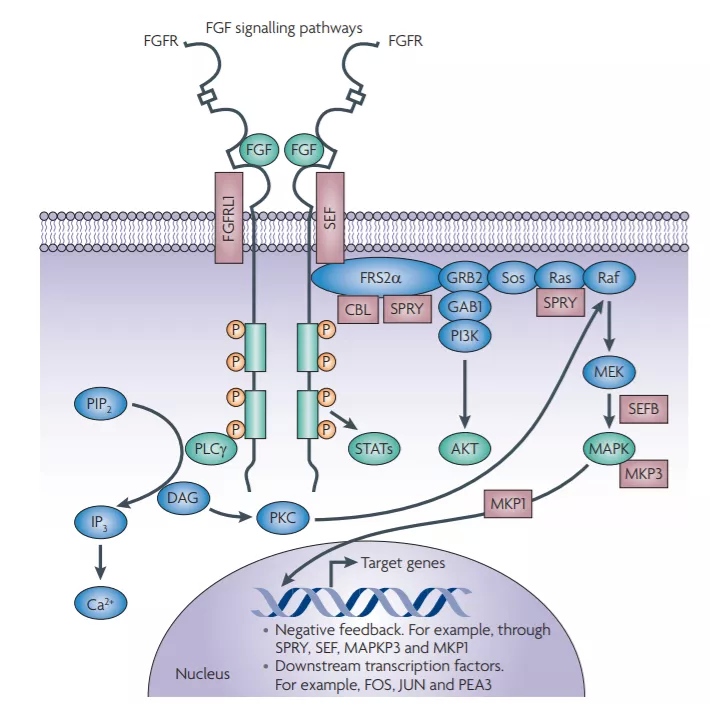
▲FGFR介导的四个关键信号通路(图片来源:参考资料[3])
根据2015年发表在Clinical Cancer Research的一项研究,针对4853个各类实体瘤的下一代测序(NGS)显示,大约有7.1%的癌症中发现FGFR畸变(aberrations),其中大部分是基因扩增(66%),其次是突变(26%)和重排(8%)。几乎所有检测的恶性肿瘤中均存在FGFR畸变,发生率较高的癌症有尿路上皮癌、乳腺癌、子宫内膜癌、鳞状上皮癌等。
由于FGFR异常在多种癌症中普遍存在,针对FGFR开发抑制剂有望成为癌症治疗的新选择。这类候选药通过靶向目标区域来阻断FGFR介导的信号通路,从而达到抑制肿瘤生长的目的。目前,这一靶点已成为行业热门研究领域,更是“不限癌种”疗法聚焦的靶点之一。
全球两款产品获批,开创膀胱癌、胆管癌靶向疗法新时代
据悉,已有不少靶向FGFR的候选药进入临床研究阶段。这些产品大致可以分为两大类,一种是“泛FGFR抑制剂”,它可以抑制FGFR家族的多种亚型;另一种是FGFR4抑制剂,它可以选择性的抑制FGFR4。
2019年,强生旗下杨森(Janssen)开发的口服泛FGFR抑制剂Balversa(erdafitinib)获得美国FDA加速批准。该药因此成为首款针对转移性膀胱癌的靶向疗法,同时,它也是全球首款获批上市的FGFR靶向药。该药在美获批适应症为:用于治疗携带特定致敏性FGFR3或FGFR2基因突变的局部晚期或转移性膀胱癌成人患者。在中国,erdafitinib已获批3项临床试验,适应症为接受卡介苗治疗后复发、且携带FGFR突变或融合的高危非肌层浸润性膀胱癌。
今年4月,第二款FGFR抑制剂在美国加速获批上市,为Incyte公司开发的泛FGFR抑制剂Pemazyre(pemigatinib),适应症为携带FGFR2基因融合或其它重排类型的经治晚期胆管癌成人患者,它成为全球首款晚期胆管癌靶向疗法。此前,该药曾获得FDA授予的突破性疗法认定、孤儿药资格和优先审评资格。胆管癌是一种罕见癌症,在大约9%至14%胆管癌患者的肿瘤中发现了FGFR2基因融合。在中国,信达生物拥有这款创新疗法在大中华区的开发和商业化权益。
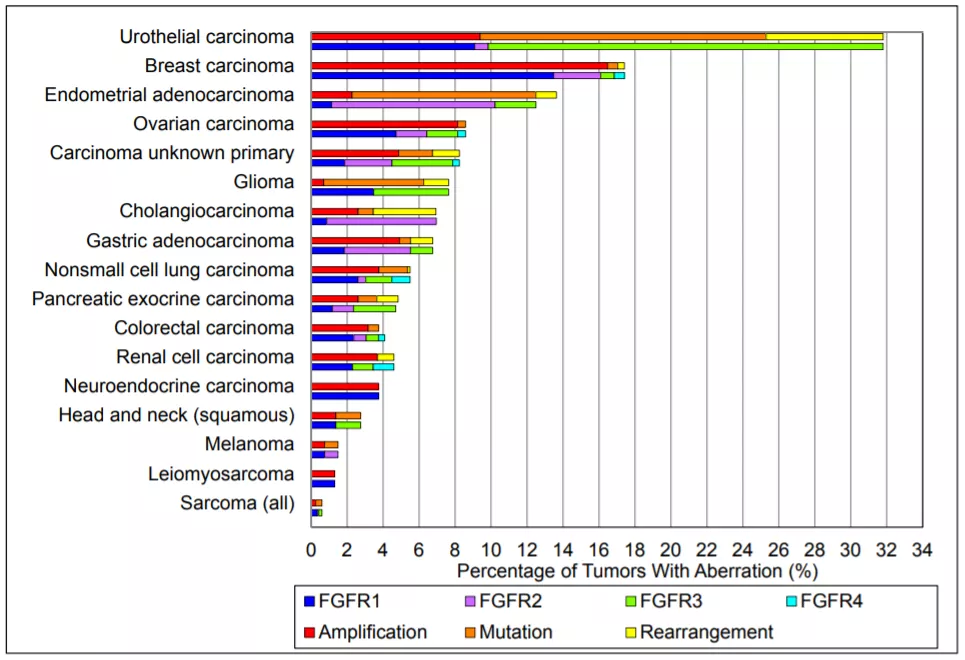
▲FGFR基因异常与肿瘤(图片来源:参考资料[1])
除了膀胱癌和胆管癌,目前全球在研FGFR靶向药在肺癌(针对FGFR1/2/3的小分子抑制剂BGJ398和AZD4547)、肝癌(FGFR4强效抑制剂BLU-554)、乳腺癌(非选择性FGFR抑制剂lucitanib)、尿路上皮癌(针对FGFR3的单抗vofatamab)等肿瘤的临床试验中,均取得了不错的进展。
此外,这类靶向疗法还有望治疗肿瘤以外的其他适应症。2019年,辉瑞公司从Therachon公司获得一款重组人类FGFR3诱饵蛋白候选药TA-46,有望成为治疗软骨发育不全潜在“first-in-class”生物制剂。此前,它已获得欧洲药品管理局(EMA)和美国FDA授予的孤儿药资格。
诺诚健华、信达生物等中国医药公司纷纷加入
目前尚未有FGFR抑制剂在中国获批上市。不过,已有不少中国公司正在涉足这一领域,包括诺诚健华、信达生物、基石药业、再鼎医药等,候选药最快进展至临床3期。这些在研产品中,大部分为口服小分子靶向药。其中,基石药业与和誉医药开发的产品均为选择性FGFR4抑制剂,再鼎医药旗下针对FGFR2b过度表达肿瘤的候选药则是一款单克隆抗体药物。以下节选部分在研FGFR抑制剂信息与大家分享。
诺诚健华:该公司自主研发了一款基于结构优化设计的高选择性小分子泛FGFR抑制剂ICP-192,可用于治疗多种实体瘤,目前正在中国和美国开展多项临床研究。近期,该产品先后在两项2期临床中完成首例尿路上皮癌和胆管癌患者入组。据悉,诺诚健华正在探索ICP-192针对不同癌种实现“异病同治”的可能性。除了单药治疗,该公司还将收集更多的数据,以评估ICP-192与免疫检查点抑制剂等治疗药物联合使用作为FGFR突变患者的潜在治疗选择。
信达生物:pemigatinib是由Incyte公司发现和研发,并已在美国获批上市FGFR抑制剂,信达生物于2018年获得该产品血液病和肿瘤适应症在大中华区的开发和商业化权利,并于今年3月完成治疗中国晚期胆管癌患者的2期关键性注册研究的首例患者给药。在一项2期临床试验中,pemigatinib单药治疗既往经治的局部晚期或转移性胆管癌伴FGFR2基因融合或重排的患者,主要终点ORR达到36%,DCR达82%,中位PFS为6.9个月,且总体耐受性良好。
基石药业:fisogatinib是由Blueprint Medicines开发的一款高选择性FGFR4抑制剂。此前,基石药业与该公司已达成独家合作和授权,获得了候选药在大中华区的独家开发和商业化授权。今年1月,两家公司已启动PD-L1抑制剂与fisogatinib联合治疗局部晚期和转移性肝细胞癌(HCC)患者的1b/2期临床试验。早期临床研究已显示fisogatinib单药治疗HCC患者的疗效和耐受性,此外,该产品联合PD-L1对于FGFR4驱动的晚期HCC患者也有一定治疗潜力。
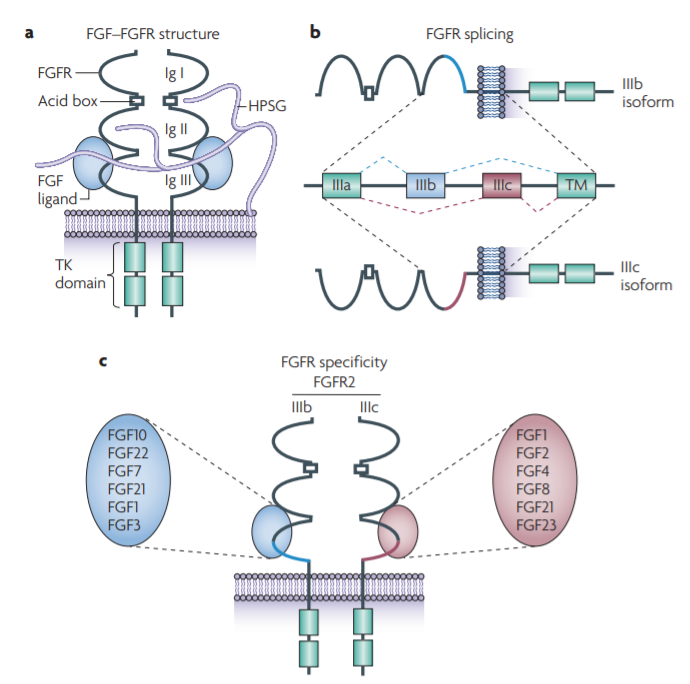
▲FGFR及其配体的结构(图片来源:参考资料[3])
再鼎医药:bemarituzumab是一款同类最优的同源异构体选择性单克隆抗体,是针对FGFR2b过度表达肿瘤的靶向免疫疗法,通过增强抗体依赖性细胞介导的细胞毒作用(ADCC)直接杀死肿瘤细胞。再鼎医药从Five Prime公司获得bemarituzumab在大中华区的独家许可,目前两家公司正在开展一项名为FIGHT研究的3期关键性临床研究,以探索该药联合化疗一线疗法治疗胃和胃食管交界处癌的作用。研究显示,大约有10%的胃癌患者具有FGFR2b过表达或FGFR2基因扩增。根据再鼎医药2019年上半年年报,由于FGFR2b生物标志物阳性率稳定保持在30%以上,该研究入组进度比计划提前。
和誉医药:该公司独立开发了一款拥有全球知识产权的创新FGFR4小分子口服抑制剂ABSK011,其优良的活性、选择性及其它理化特性预示着该药物具有成为全球“best-in-class”潜力。研究发现,在肝癌中经常存在FGFR4信号通路过度激活现象。目前,该产品正在中国台湾地区开展针对肝细胞癌的临床研究。此外,和誉医药还与阿斯利康(AstraZeneca)就FGFR抑制剂AZD4547的开发和商业化达成全球性独家授权协议,该候选药已在美国和欧洲开展多项早期试验。
仑胜医药:该公司正在开发一款口服泛FGFR抑制剂derazantinib,是肝内胆管癌(iCCA)和其它因FGFR突变引起癌变的肿瘤潜在治疗方法。去年4月,该产品治疗FGFR2基因融合阳性且至少一线系统治疗失败的不可手术切除或晚期iCCA受试者的注册临床试验,在中国获得批准。此前,该产品在针对含有FGFR2基因融合的iCCA患者的临床1/2期研究中取得不错效果,客观缓解率高达21%,比标准化疗高近3倍。据悉,仑胜医药合作伙伴Basilea公司正在针对美国和欧洲含有FGFR2融合基因的二线iCCA患者进行一项类似的全球注册研究。
思路迪:3D185是一款FGFR1/2/3小分子抑制剂,该项目的早期开发和临床前研究由海和生物和中国科学院上海药物研究所共同完成,2018年,思路迪获得了它用于肿瘤和肺纤维化治疗的全球开发授权。临床前研究表明,3D185具有抗肿瘤活性强,PD-PK特征优良,毒性低和生物利用度高等优点,且有CSF1-R靶向作用,适合在肿瘤治疗领域及与PD-1/PD-L1联合用药。目前正在开展的临床研究是一项单臂、多次给药、剂量递增1期临床研究。
贝达药业:BPI-17509是贝达药业自主研发的拥有全新化学结构的FGFR1/2/3小分子口服抑制剂,拟用于肝内胆管癌、膀胱癌和肺鳞癌等FGFR基因变异等实体瘤的治疗。去年2月,该产品在中国获批临床,贝达药业已于去年9月启动了该产品治疗晚期实体瘤的1期临床试验。
和黄医药:HMPL-453是和黄医药开发的一款FGFR1/2/3抑制剂,已完成了在中国晚期恶性间皮瘤患者中的1期研究,并着手开展2期临床研究的计划。
此外,还有许多其它在研FGFR抑制剂已在中国获批临床,包括日本卫材公司(Eisai)开发的E7090,该药已在中国获批临床,针对的适应症为不可切除的FGFR2基因融合晚期或转移性胆管癌患者。
未来诸多潜力有待发掘
值得一提的是,目前已获批上市的两款FGFR抑制剂,均需要用FDA批准的伴随检测试剂盒,来检测患者是否携带适用的基因突变。这不禁让人展望,未来这个领域能否产生跨癌种的靶向精准疗法诞生?
据悉,已有公司将FGFR作为“不限癌种”疗法聚焦的靶点。其中,杨森公司正在中国和美国开展2期临床试验,使用“篮子“试验设计,检验erdafitini治疗携带FGFR激活性基因变异的实体瘤患者。另外,Debiopharm公司和Taiho
Oncology公司也正在分别开展候选药Debio 1347和TAS-120在携带FGFR激活性变异的实体瘤的2期临床研究。
随着临床研究的深入开展,科学家们还发现FGFR基因扩增程度越高的患者,对于FGFR抑制剂的反应越好。这也提示,FGFR不仅可以作为一个靶点,还有望成为疗效预测指标。可见,这个领域仍有诸多潜力有待发掘。
我们预祝针对FGFR的研究能够取得更多新突破,开发出更多有效的创新疗法,从而惠及更多患者。
(编辑:宇硕)






