当众多生物创新药公司还在国内市场相互博弈时,复宏汉霖(02696)已经拿到了通往广阔国际市场的“门票”。
4月23日,复宏汉霖宣布,公司已顺利通过HLX02曲妥珠单抗原液和制剂线的欧盟GMP现场核查,正式获得波兰卫生监督机构Chief Pharmaceutical Inspector签发的两项欧盟GMP证书。
智通财经APP了解到,作为国际公认的最权威和严谨的认证之一,欧盟GMP认证一直以来被视为药品登陆国际市场的“通行证”,而HLX02(注射用曲妥珠单抗)则是国内首个获得欧盟GMP认证的国产生物类似药。得到欧盟GMP认证充分说明了复宏汉霖自主研发和生产的高品质生物药已获得全球权威药监机构的高度认可,公司内在价值已实现进一步释放。
质量管理体系与研发成果获业界权威背书
获得欧盟GMP认证,打通HLX02(注射用曲妥珠单抗)通往全球市场的大门,对于复宏汉霖而言无疑是一个重要里程碑。
智通财经APP了解到,在完善法律框架下发布的欧盟《生物类似药指南》于2005年正式生效,在法规和药政层面上为欧洲生物类似药的注册开辟了道路。在随后十几年里,多个生物类似药在欧洲市场相继获批上市,带动了全球生物类似药的迅速发展,并为美国等全球其他区域市场在药政监管、市场调控等多个方面树立了榜样和标杆。
目前,欧盟GMP认证不仅在近30个成员国之间彼此互认共享,同时也可与美国、加拿大等签订互认协议(MRA)的国家共享核查结果,在全球范围内具有重大影响力。因此,欧盟GMP认证的加持也将是HLX02(注射用曲妥珠单抗)进入国际市场的关键所在。
据悉,徐汇基地顺利通过此次GMP现场核查,基于其设计和施工时便参照了欧盟、中国及美国的质量标准。实际上,复宏汉霖一直坚持对标国际最高水平,希望以质高价优的创新生物药亮相国际舞台,与国际顶尖的生物制药公司同台竞技。在公司看来,全面完善的质量管理体系是公司“走出去”的前提。为此,复宏汉霖耗时十年,已建立起一套全面的质量管理体系,符合国际的质量标准,为公司产品在多个司法权区及地区的商业化奠定基础。
智通财经APP了解到,复宏汉霖的质量管理体系覆盖了从产品研发到物料管理、产品生产、质量控制、产品供应链管理及产品上市后监督的整个产品周期。在此次获得欧盟GMP认证之前,徐汇基地及配套的质量管理体系已通过由中国国家药监局、欧盟质量受权人(QP)以及国际商业合作伙伴进行的多项实地核查及审计,且公司首个产品汉利康®已正获得《药品GMP证书》。
从产能情况来看,目前公司徐汇基地拥有产能14000L的生物药生产线,包括6台2000升及4台500升的一次性生物反应器及配套纯化设备。复宏汉霖正在上海松江建设其第二个商业化生物医药生产基地,竣工投产后将成为国内大型生物医药生产基地,在HLX02(注射用曲妥珠单抗)即将落地的关键节点,持续的产能建设以及先进的一次性生物技术无疑能够支撑公司未来规模化生产需要。
“中国籍”曲妥珠单抗走向国际舞台
对于复宏汉霖来说,要想将HLX02推向国际舞台,首先需要将其推向欧洲。
作为目前全球上市生物类似药最多的市场,早在2018年,欧洲生物类似药市场规模便已超过30亿美元,占全球市场一半以上。但由于欧洲集中审批程序(Centralized Procedure)对申报药物的质量要求很高,使得自2006年至2019年9月,欧洲EMA也仅批准了27种单抗类生物类似药。为此,当前在欧洲规范市场的参与者也只有包括诺华山德士、辉瑞、迈兰和安进在内的不到10家跨国药企。
智通财经APP了解到,HLX02(注射用曲妥珠单抗)为首个且目前唯一一个获得欧洲药品管理局(EMA)受理营销授权申请(MAA)的“中国籍”生物类似药。
作为中国首个开展国际多中心(中国大陆、乌克兰、波兰和菲律宾)3期临床试验的生物类似药,HLX02(注射用曲妥珠单抗)3期临床试验结果在2019年于新加坡举办的ESMO Asia年会上发布。研究证明了在HER2阳性复发或转移性乳腺癌患者中,HLX02(注射用曲妥珠单抗)和原研曲妥珠单抗具有相似的疗效和安全性。
据了解,在欧盟药品法规框架下,药品的审批周期是210天,在这段时间内审评方需要出具上市审评意见,而现场核查是这一审评流程中关键的环节之一。随着GMP现场核查通过,意味着HLX02(注射用曲妥珠单抗)的MAA审评流程已走到后期阶段,正式登陆欧洲市场胜利在望。
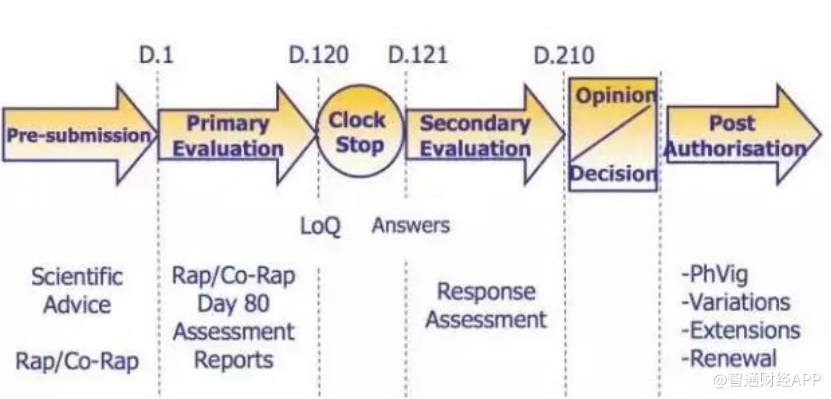
(生物类似药在欧盟的审评流程)
要想将重磅产品化成估值的真金白银,就需要公司积极布局商业化,持续增强全球生物药市场上的话语权和竞争力。通过持续的国际合作,复宏汉霖已经走到了HLX02(注射用曲妥珠单抗)规模变现的黎明。
目前,复宏汉霖已针对HLX02(注射用曲妥珠单抗)前瞻性地开展了国际商业化布局,积极开拓海外市场。公司分别与Accord、Cipla、Mabxience和雅各臣药业等国际一流的生物制药企业达成合作,促进HLX02(注射用曲妥珠单抗)在全球80多个国家和地区的商业化进程。
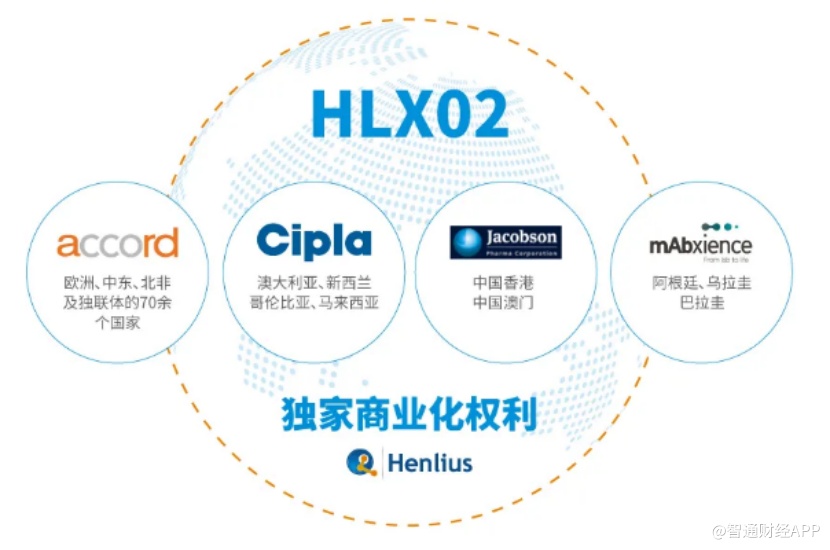
以Accord为例,作为一家全球性制药公司,Accord专注于仿制药产品和生物仿制药的开发、制造和销售,业务覆盖北美、欧洲、澳洲、南非等地区。2018年6月下旬,复宏汉霖与Accord签订合作协议,授权其在欧洲地区包括英国、法国、德国和意大利等在内的53个国家,中东及北非地区17个国家和部分独联体国家对HLX02(注射用曲妥珠单抗)产品进行独家商业化开发。该协议可以让复宏汉霖借助Accord渠道快速进入欧洲市场。
而在今年3月31日,复宏汉霖宣布与全球性生物技术公司Mabxience签订独家许可协议,授予其在阿根廷、乌拉圭及巴拉圭针对HLX02(注射用曲妥珠单抗)在肿瘤治疗领域的开发及商业化独家权利。从全球市场的角度来看,南美洲发展中国家对于高质量、可负担药物的用药需求亟待满足,而借助Mabxience在南美洲的既有资源,复宏汉霖能够进一步加快HLX02(注射用曲妥珠单抗)的国际化进程,惠及更多新兴市场国家的患者。
综上所述,此次获得业界权威的欧盟GMP认证,说明复宏汉霖现已建立了一套成熟的质量控制和生产体系,为核心产品HLX02(注射用曲妥珠单抗)未来上市销售做好了充分的准备。而通过与Accord等国际药企的合作,待HLX02(注射用曲妥珠单抗)获批上市,势必将迎来国际化商业开发的黄金阶段,而届时复宏汉霖也将迎来新一轮的估值增长期。






