本文来自微信公众号“Insight数据库”,作者张小乙。
FDA的一则通告让一款全球累积销售额接近1000亿美元的老药在美销售按下暂停键,那国内市场会发生什么变化呢?
美国FDA官网4月1日的消息,FDA要求所有药企立即从下架所有雷尼替丁药物,因在雷尼替丁中发现了一种可致癌的亚硝酸胺杂质——N-亚硝基二甲胺(NDMA)。
雷尼替丁曾多次位居全球药品销售额第一的宝座,据公开数据,雷尼替丁2017年全球销售额达到4.12亿美元。自1985年进入中国之后,大量企业仿制该品种,加上同类药物相继入市,雷尼替丁在国内市场销售额逐渐衰退。
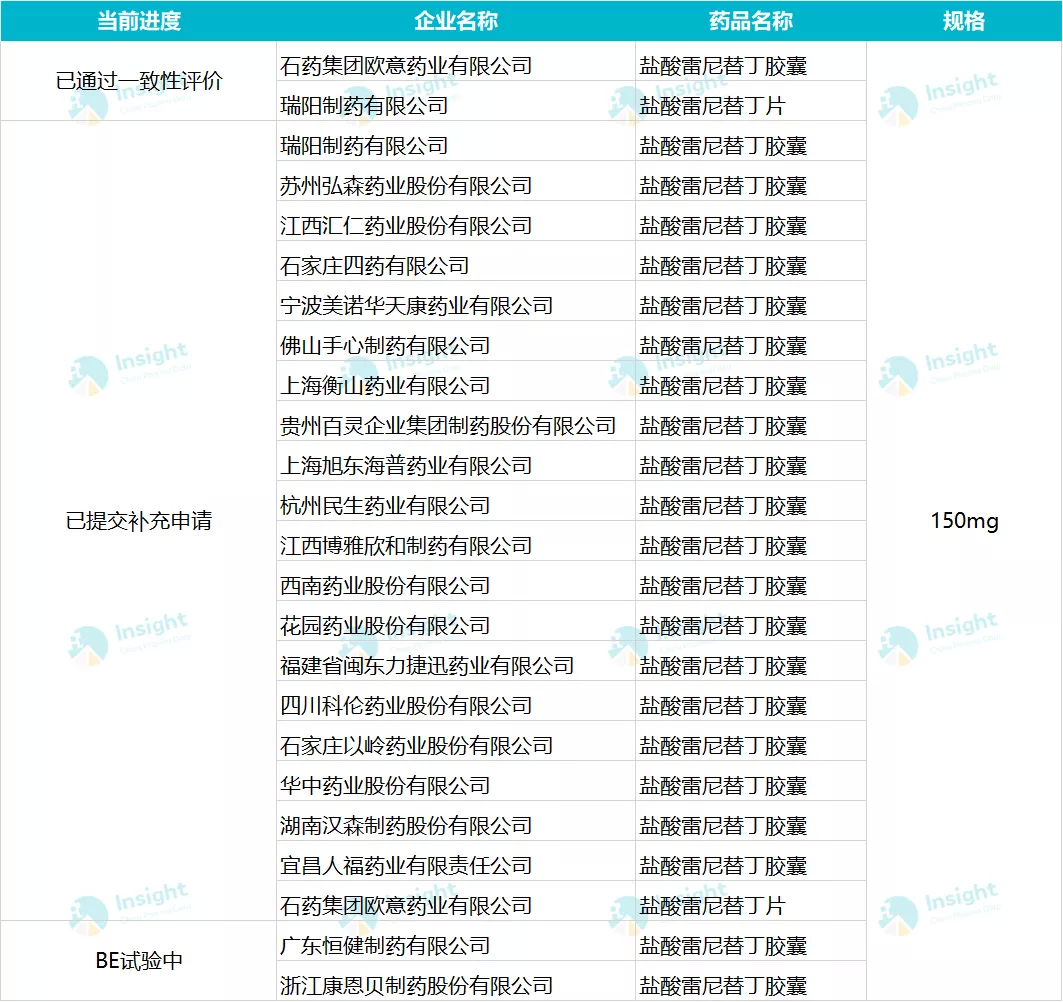
据Insight数据库显示,目前国内有743个批准文号,其中瑞阳制药在2019年9月通过一致性评价。有20家企业已经递交补充申请,有2家正在进行BE试验。
数据来源:Insight数据库
此次FDA发出的下架消息虽是面向美国,但国内相关企业也需要提高警惕,在他们为雷尼替丁的一致性评价耗资几百万之后(据业内估计,一款药物的一致性评价成本约为200万~1000万之间),还没来得及大规模铺占市场,但却迎来了极大的不确定性。
药典委、药监局早已发布声明
事情是从2019年9月开始发酵的。2019年9月13日,FDA在官网中第一次发布了提醒医护人员/患者在雷尼替丁样品中发现了NDMA的声明。
2019年12月9日,国家发布了关于该品种中硝酸铵杂质的一系列规则。药典委发布了《关于盐酸雷尼替丁及其制剂国家药品标准修订草案的公示》和《关于枸橼酸铋雷尼替丁、枸橼酸雷尼替丁片、枸橼酸雷尼替丁胶囊国家药品标准修订草案的公示》,对雷尼替丁相关的药品标准进行了修订,雷尼替丁标准拟增加NDMA杂质控制。
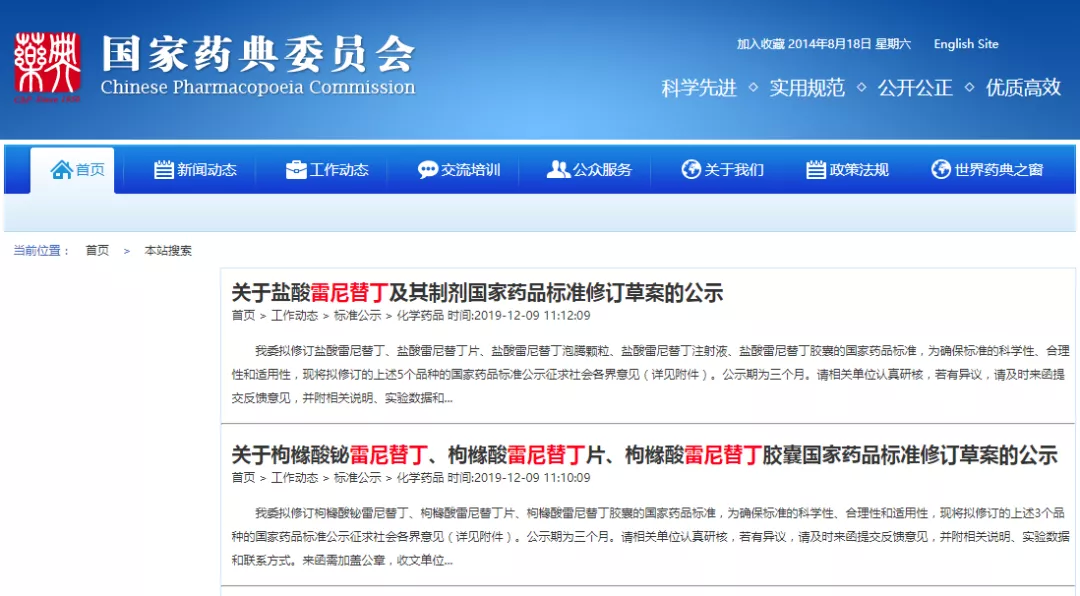
关于枸橼酸铋雷尼替丁、枸橼酸铋雷尼替丁片和枸橼酸铋雷尼替丁胶囊,增订了【生产要求】即:应对生产工艺进行评估以确定形成遗传毒性杂质N-亚硝基二甲胺等的可能性。必要时,应采用适宜的分析方法对产品进行分析,以确认N-亚硝基二甲胺等的含量符合我国药品监管部门相关指导原则或
ICH M7 指导原则的要求。
2020年1月6日,国家药监局官网发布了公开征求《化学药物中亚硝胺类杂质研究技术指导原则(征求意见稿)》意见,其中提到,亚硝胺杂质令人关注,可能会导致人类癌症。尽管某些食物和饮用水含有亚硝胺,但药物中不应存在这一物质。
上述意见稿称,由于亚硝胺类杂质在人体中可接受限度较小,微量杂质的检测和控制难度大,因此对于亚硝胺类杂质的控制应采取避免为主,控制为辅的策略。对于明确有亚硝胺类杂质残留风险的品种应建立合适的分析方法,确保成品中亚硝胺类杂质低于限度要求。
对于正在申报上市和已上市的药品,分别给予不同的指导:
对于申报上市的产品,申请人在研发中,应进行亚硝胺类杂质的风险评估,对明确有亚硝胺类杂质潜在风险的品种应进行充分的研究,在申报资料的相应章节提交亚硝胺类杂质的研究资料及检测结果,同时应注意用于研究的样品的批次、批量必须具有代表性以及科学依据。
对于已上市药品,药品批准文号持有者/生产厂也应主动对于亚硝胺类杂质存在的风险进行评估,若存在潜在的亚硝胺类杂质产生风险,可参照本指导原则以及其他相关指导原则的要求进行研究,根据研究结果采取相应的措施,以防止或最小化患者亚硝胺类杂质的暴露。
FDA 的这一通告使得雷尼替丁中「存在潜在的亚硝胺类杂质产生风险」变得明确起来,按上述法规要求,瑞阳制药已经通过一致性评价的品种,应「参照本指导原则以及其他相关指导原则的要求进行研究,根据研究结果采取相应的措施,以防止或最小化患者亚硝胺类杂质的暴露。」这意味着,这企业在投入几百万进行一致性评价研究之后,还要再次补充亚硝酸胺杂质的研究。
缬沙坦事件:华海全球召回产品、变更工艺,后再获批
此前,华海药业缬沙坦药物中发现硝酸胺杂质后,该公司曾在全球召回产品、变更工艺,遭遇市值缩水。据华海药业2018年财报数据,该事件引致华海药业召回损失、存货减值损失、补偿损失等根据实际发生情况累计计提损失约超4亿元。
直到2020年3月26日,华海药业发布公告称,收到国家药监局核准签发的关于缬沙坦片的《药品补充申请批件》,才重新具备在国内市场销售该药品的资格。
缬沙坦是一种血管紧张素II受体拮抗剂,降低血压同时不影响心脏肌肉的收缩和节律,是一种理想的降压药。起因于2018年7月8日,华海药业对外公告,在对缬沙坦原料药生产工艺进行优化评估的过程中,在未知杂质项下,发现并检定其中一未知杂质,N-亚硝基二甲胺。经调查该杂质系缬沙坦生产工艺产生的固有杂质,含量极微,但该杂质含有基因毒性。随后,华海药业开始在美国等多个国家和地区召回缬沙坦原料药。
此事也引起监管层面对缬沙坦降压药含毒性杂质的关注。2018年8月20日,国家药监局在官网上公示国家药典委《关于缬沙坦国家标准修订稿》,增订缬沙坦生产要求:必须对生产工艺进行评估以确定形成NDMA的可能性。必要时,需对生产工艺进行验证以说明在成品中NDMA的含量符合规定,限度不得超过千万分之三。
缬沙坦事件让监管部门开始重视药物中可能含有亚硝酸胺的危害,在缬沙坦原料药中检出N-亚硝基二甲胺(NDMA)起,陆续在其它沙坦类原料药中检出了各类亚硝胺杂质,如NDMA、N-亚硝基二乙胺(NDEA)等,WHO、各国的监管部门分别发布了关于亚硝酸胺的规定。
国内药企的雷尼替丁究竟会作何处置目前尚是未知数。但明确的是,药品质量问题正引起越来越多监管部门重视,药品质量应是始终高挂于药企头上的达摩克利斯之剑。
(编辑:林喵)