本文来自微信公众号“陆家嘴医药代表”,作者:邹朋、赵利建。
行业近况
近期,Moderna针对COVID-19的mRNA-1273疫苗完成首例患者给药,复星(02196)与BioNTech约定在中国合作开发针对COVID-19的BNT162疫苗(mRNA疫苗),引起了市场对mRNA疫苗的较大关注。对此,我们对mRNA的技术发展、优势、临床进展及重点公司进行了梳理,供投资者参考。
评论
mRNA疫苗拥有较多优势
相比传统疫苗(减毒、灭活、重组亚单位等疫苗),mRNA疫苗生产工艺简单、无需细胞培养或动物源基质、合成速度快、成本低。相比同属核酸疫苗的DNA疫苗,mRNA疫苗发挥作用无需进入细胞核,没有整合至宿主基因组的风险,且为一过性表达,半衰期可以通过修饰进行调整。因此我们预计,mRNA疫苗拥有明朗的发展前景。
mRNA疫苗有望在突发疫情中发挥重要作用
mRNA疫苗由于合成工艺简单、生产速度快,从基因测序至生产只需要数周的时间,因此在对时间要求比较紧急的疫情中有望发挥重要作用。在此次COVID-19疫情中,Moderna的mRNA-1273是全球首个进入临床I期试验的疫苗,COVID-19的基因序列于2020年1月11日公布,Moderna于1月13日完成mRNA疫苗序列研究工作,2月7日完成首批样品的制备,3月3日开始I期临床,3月16日完成首例患者给药。
mRNA疫苗也可以对肿瘤疾病发挥作用
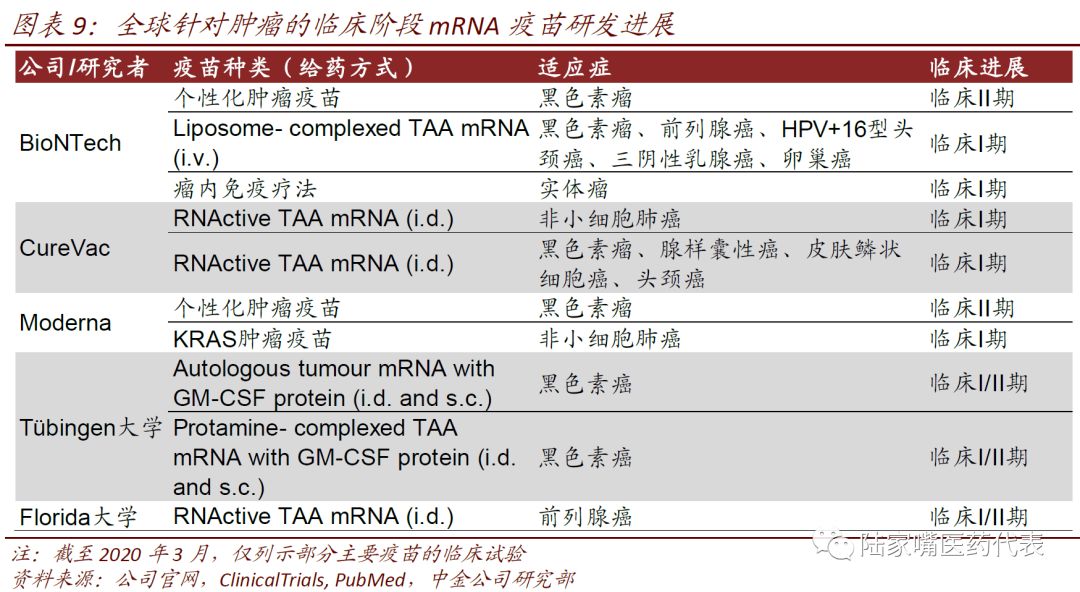
与传统疫苗不同的是,mRNA疫苗对非感染性疾病也可以发挥作用,肿瘤是mRNA疫苗应用的重要领域之一。全球领先的3家mRNA疫苗公司,Moderna、BioNTech、CureVac均在肿瘤领域建立了自己的产品线,包括针对个体的个性化肿瘤疫苗以及通用的肿瘤疫苗,部分已经开展I/II期临床。
风险
临床进展不及预期,人体内临床结果与动物、体外试验相差较大,产品注册缓慢。
mRNA疫苗简介
mRNA疫苗技术发展
早期技术缺陷使mRNA疫苗研究进展缓慢。1990年,Wolff等人发现在小鼠肌肉组织中注射含有特定基因的质粒DNA或mRNA,小鼠组织局部会产生该基因编码的蛋白产物,此后多项研究发现用核酸免疫动物,可以诱导机体产生针对该核酸编码抗原的免疫力。但由于mRNA不稳定、在组织内易被降解、细胞吸收率较低等缺陷,其研发进展缓慢,更多研究放在DNA疫苗领域。
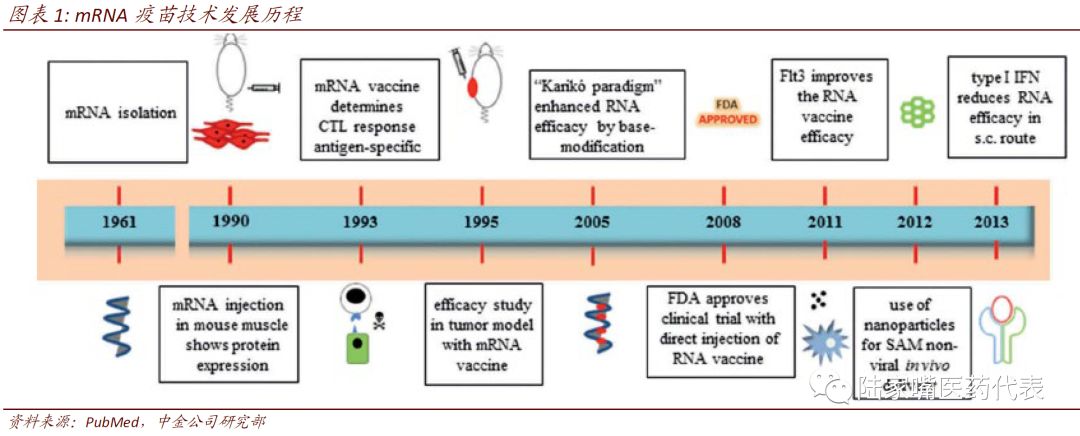
mRNA疫苗发挥作用需要克服多重阻碍。mRNA疫苗注射至机体内后,1)首先需要从细胞外进入细胞内,但是mRNA疫苗稳定性差,且细胞内外均含有较多核酸酶,mRNA疫苗需要特定的保护以避免被降解,且需要一定的帮助提高通过细胞膜进入细胞的效率。2)mRNA疫苗通常以内涵体的形式进入细胞,但要发挥作用需要进入细胞质内,因此需要从内涵体中释放并避免过早被降解,其翻译表达过程也需要一些工具的调节。
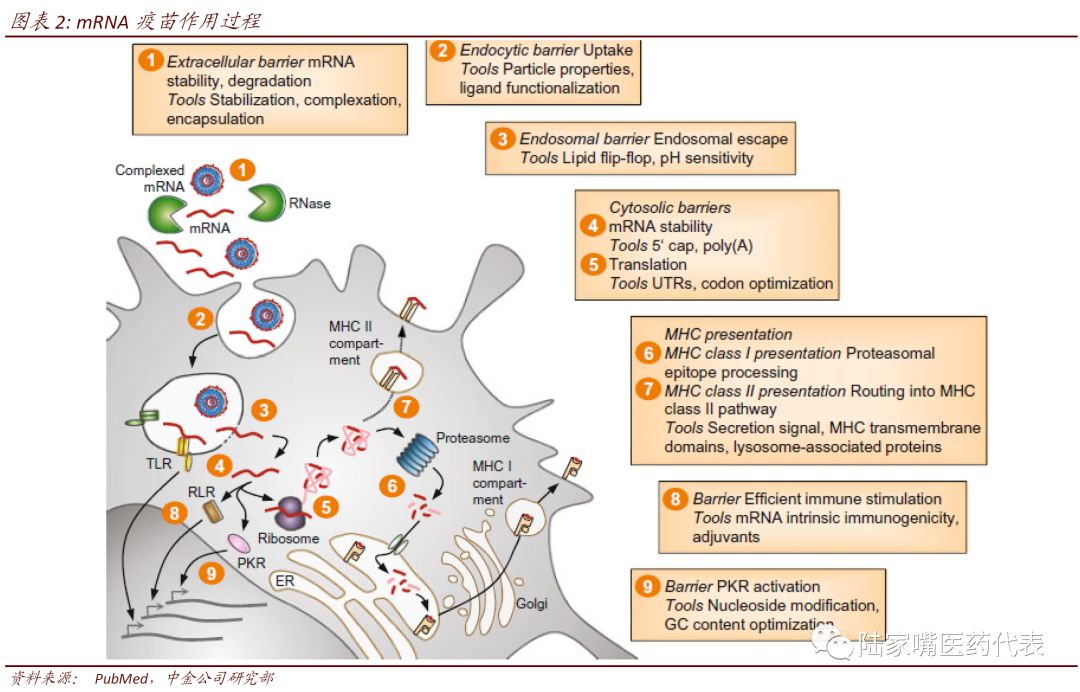
新技术发展使得mRNA疫苗重新得到重视。21世纪后,mRNA合成、修饰和递送技术的发展使得克服mRNA疫苗上述缺陷成为可能,mRNA疫苗的研发重新得到重视。mRNA疫苗是在体外合成含有编码特定抗原的mRNA序列,然后将mRNA导入至机体内,宿主细胞摄取mRNA后,mRNA即在宿主细胞内进行翻译表达,合成抗原蛋白,即可诱导机体产生针对该抗原的免疫应答,从而产生免疫保护。mRNA疫苗的生产过程如下。
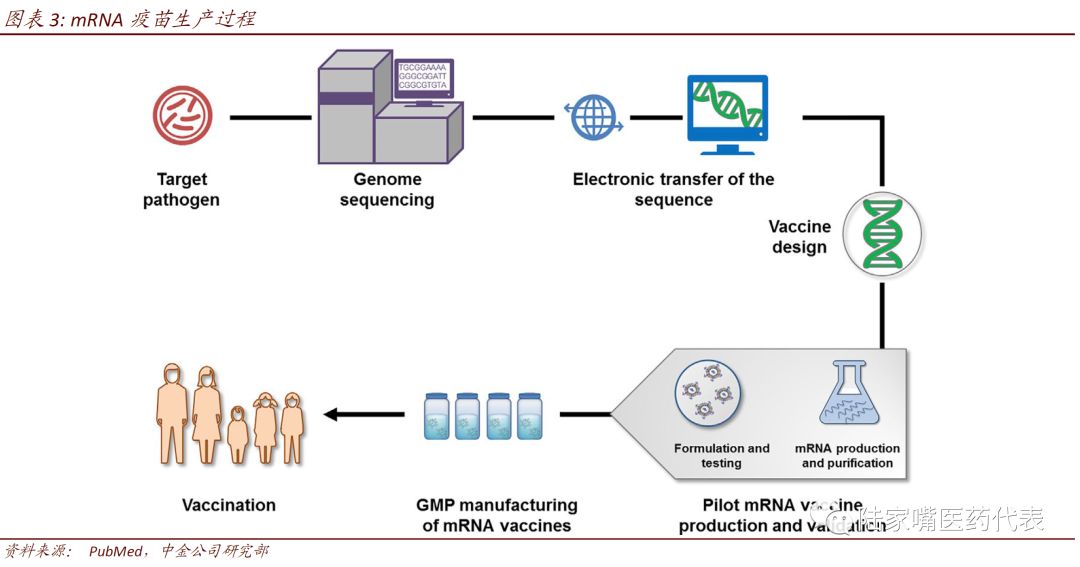
mRNA疫苗拥有较多优势
mRNA疫苗拥有较多优势。相比传统疫苗,mRNA疫苗生产工艺简单、无需细胞培养或动物源基质、合成速度快(从基因测序至生产只需要几周的时间)、成本低。相比DNA疫苗,mRNA疫苗无需进入细胞核,没有整合至宿主基因组的风险,且为一过性表达,半衰期可以通过修饰进行调整。

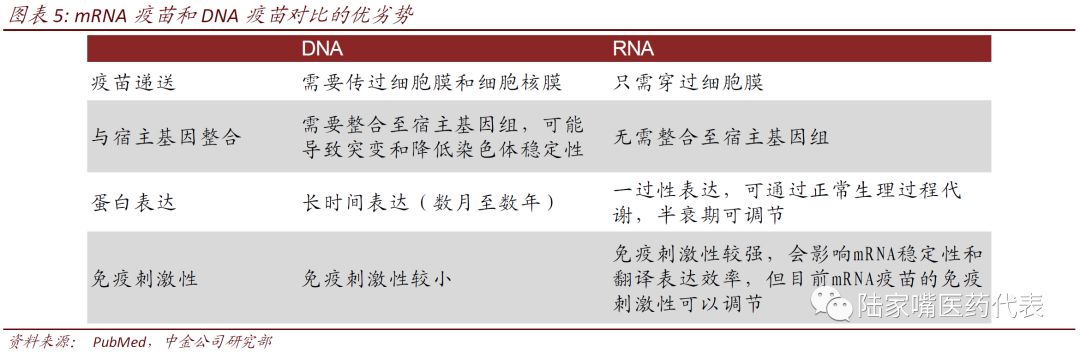
传统mRNA疫苗和自我扩增mRNA疫苗
mRNA疫苗可分为传统mRNA疫苗和自我扩增mRNA疫苗。目前有两种形式的mRNA疫苗,传统的mRNA疫苗(Conventional mRNA)的开放阅读框(open reading frame,ORF)只含有编码抗原的基因;自我扩增型mRNA疫苗(Self-amplifying mRNA,SAM)的ORF不仅包含编码抗原的基因,还包括RNA扩增需要的非结构蛋白,可以使mRNA进行扩增,增加目的抗原的表达量。除ORF外,两种疫苗均含有由5’非翻译区(untranslated region,UTR)、3’非翻译区、5’帽子结构(Cap)和多聚腺苷酸尾巴(Poly-A)
5’UTR和3’UTR中的调节元件可以增强mRNA的稳定性,并提高mRNA的翻译效率。
Cap可以使得mRNA沿着正确的方向进行翻译。
Poly-A一般为100-250个bp长度,其可以增强mRNA的稳定性。
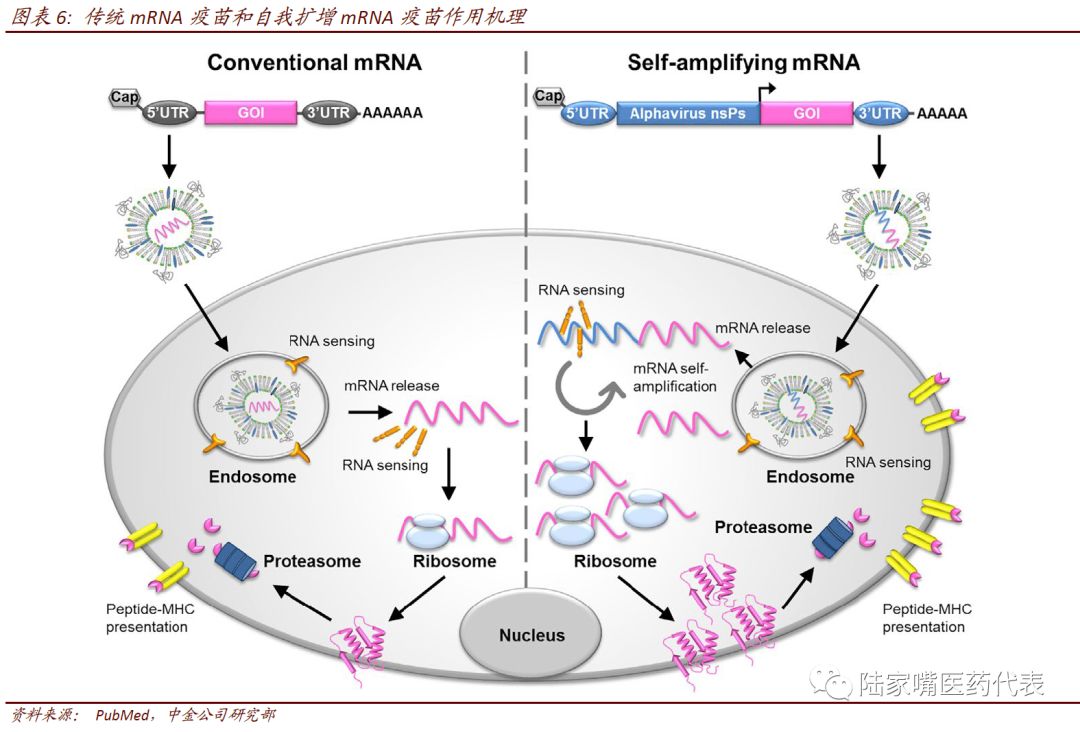

脂质体载体对mRNA疫苗发展有重要促进作用
新的工具改善mRNA疫苗性能。由于mRNA自身的稳定性差,易被组织内的核酸酶降解;且进入细胞的效率较低;翻译效率较低,这些缺陷最开始限制了mRNA疫苗的应用。但近十年来,新的技术发展逐渐产生了针对这些缺陷的方法,包括增强mRNA的稳定性和翻译效率、调节mRNA疫苗的免疫原性等;主要的工具有mRNA疫苗的递送载体、5’UTR和3’UTR的调节元件、Cap结构、Poly-A、codon optimization以及给药方式的选择等。领先的mRNA疫苗厂商在载体、结构元件等方面进行了专利布局。
载体:通过将mRNA装配在载体中,可以避免mRNA进入细胞过程中过快的被体内的核酸酶降解,并且脂质体载体有助于将mRNA输送至细胞内进行翻译表达。
核苷酸修饰:可以降低人体对mRNA的固有免疫反应。
Codon modification(密码子修饰):将mRNA中较为罕见的密码子换为更常见的同义密码子,可以提高蛋白表达量。
5’UTR和3’UTR:其中的一些调节元件可以增强mRNA的稳定性,并提高mRNA的翻译效率,延长mRNA的半衰期。
Cap:可以增强mRNA的稳定性和提高蛋白表达量。
Poly-A:其可以增强mRNA的稳定性和翻译效率。
递送载体的研究对mRNA疫苗的发展起着非常重要的作用。递送载体对改善mRNA疫苗的稳定性和翻译效率有非常重要的作用,递送载体可分为病毒载体和非病毒载体。病毒载体由于本身有免疫原性会影响疫苗的使用;非病毒载体中以脂质体应用的最为广泛,主要包阳离子括脂质体复合物(lipoplex,LP)、脂质体聚合物(lipopolyplex,LPR)、脂质体纳米粒(lipid nanoparticle,LNP)、阳离子纳米乳(cationic nanoemulsion,CNE)等。
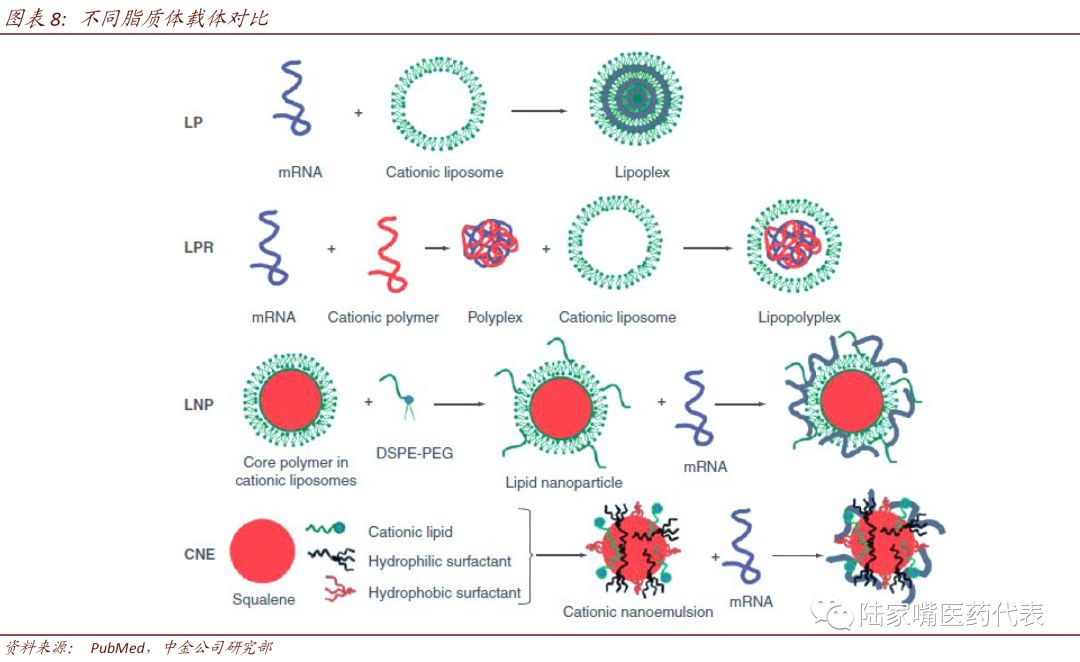
脂质体递送系统具有明显的优势。脂质体在mRNA疫苗的递送中发挥着重要的作用,其主要有以下优势:1)脂质体为囊状,可以将mRNA包括在空腔中,避免被核酸酶降解;2)脂质体性状与细胞膜相似,可以提高疫苗进入细胞的效率;3)脂质体可以促进mRNA从内涵体中释放至细胞质中;4)生产易于量化。
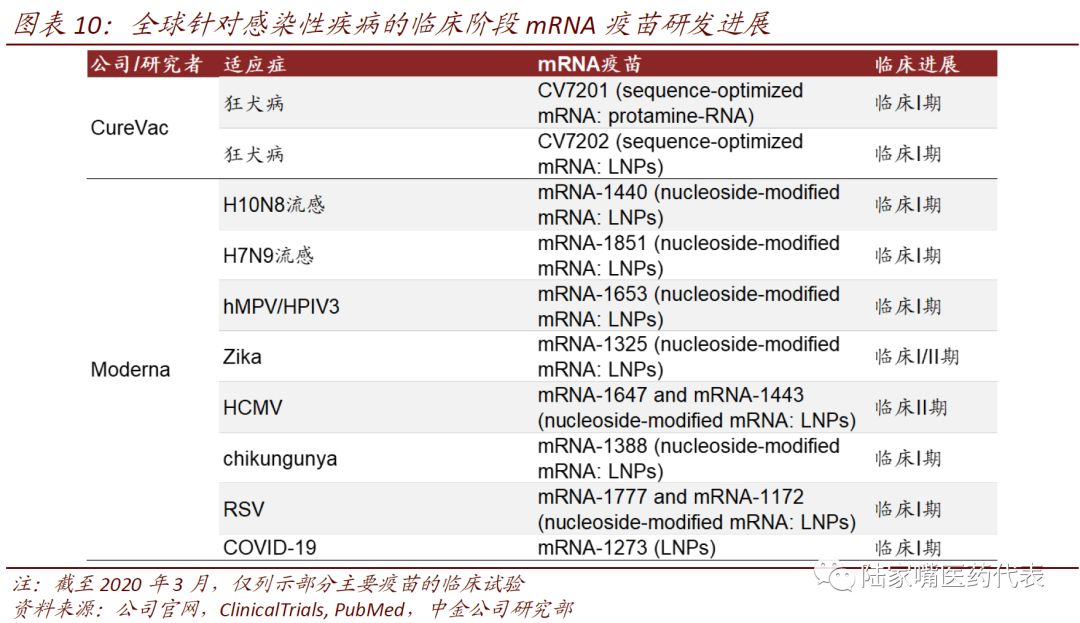
多款mRNA疫苗已进入临床
肿瘤是mRNA疫苗应用的重要领域之一。由于传统疫苗无法对非感染性疾病发挥作用,如肿瘤等疾病,而mRNA疫苗可以在非感染性疾病中发挥作用,因此非感染性疾病是mRNA应用的重要领域之一,其中肿瘤是mRNA疫苗厂商最关注的领域之一。BioNTech针对黑色素瘤个性化肿瘤疫苗在II期临床,前列腺癌、乳腺癌等的mRNA疫苗在I期临床中;CureVac针对非小细胞肺癌、黑色素瘤的mRNA疫苗在I期临床;Moderna针对黑色素瘤的mRNA疫苗已经开展II期临床;Tuebingen大学针对黑色素瘤的mRNA疫苗已经完成I/II期临床。
mRNA疫苗是首个进入临床的COVID-19疫苗。相比传统疫苗,mRNA疫苗的生产速度快,有望在大型传染病的防控中发挥重要作用。以此次的COVID-19疫情为例,最先进入临床试验的疫苗为Moderna的mRNA疫苗,COVID-19的基因序列于2020年1月11日公布,Moderna于1月13日完成mRNA疫苗序列研究工作,2月7日完成首批样品的制备,3月3日开始I期临床,3月16日完成首例患者给药。
除此外,多款针对感染性疾病的mRNA疫苗也进入临床阶段。CureVac两款狂犬病mRNA疫苗在I期临床。Moderna两款流感疫苗(H10N8、H7N9)和hMPV/PIV3的疫苗在I期临床,Chikungunya病毒、Zika病毒疫苗完成I期临床,CMV疫苗进入II期临床等。
重点公司简介
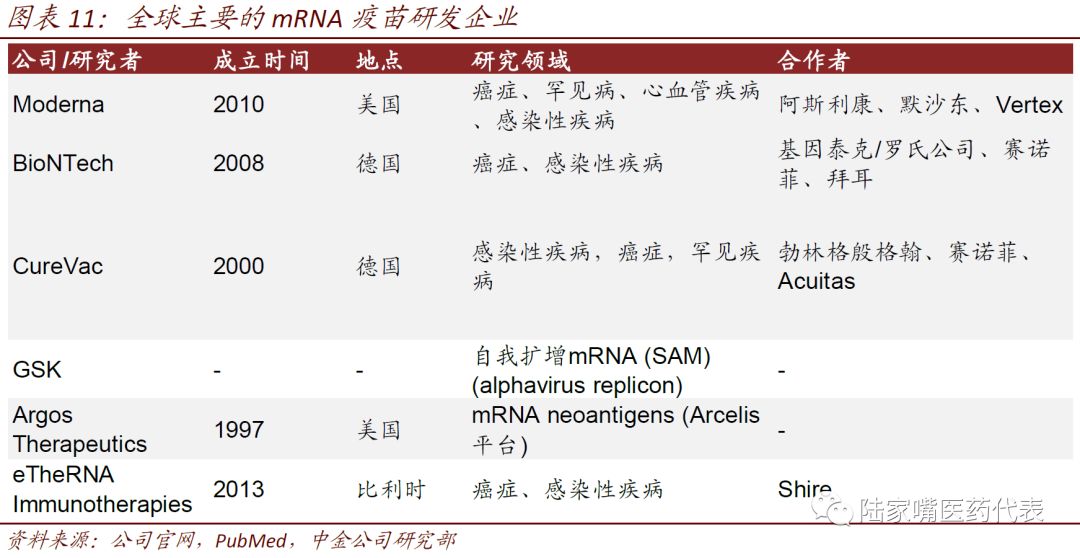
现在全球已经有多家企业在进行mRNA疫苗的研发,其中较为领先的是Moderna、BioNTech、CureVac等,几家企业的简要情况如下表所示。
Moderna
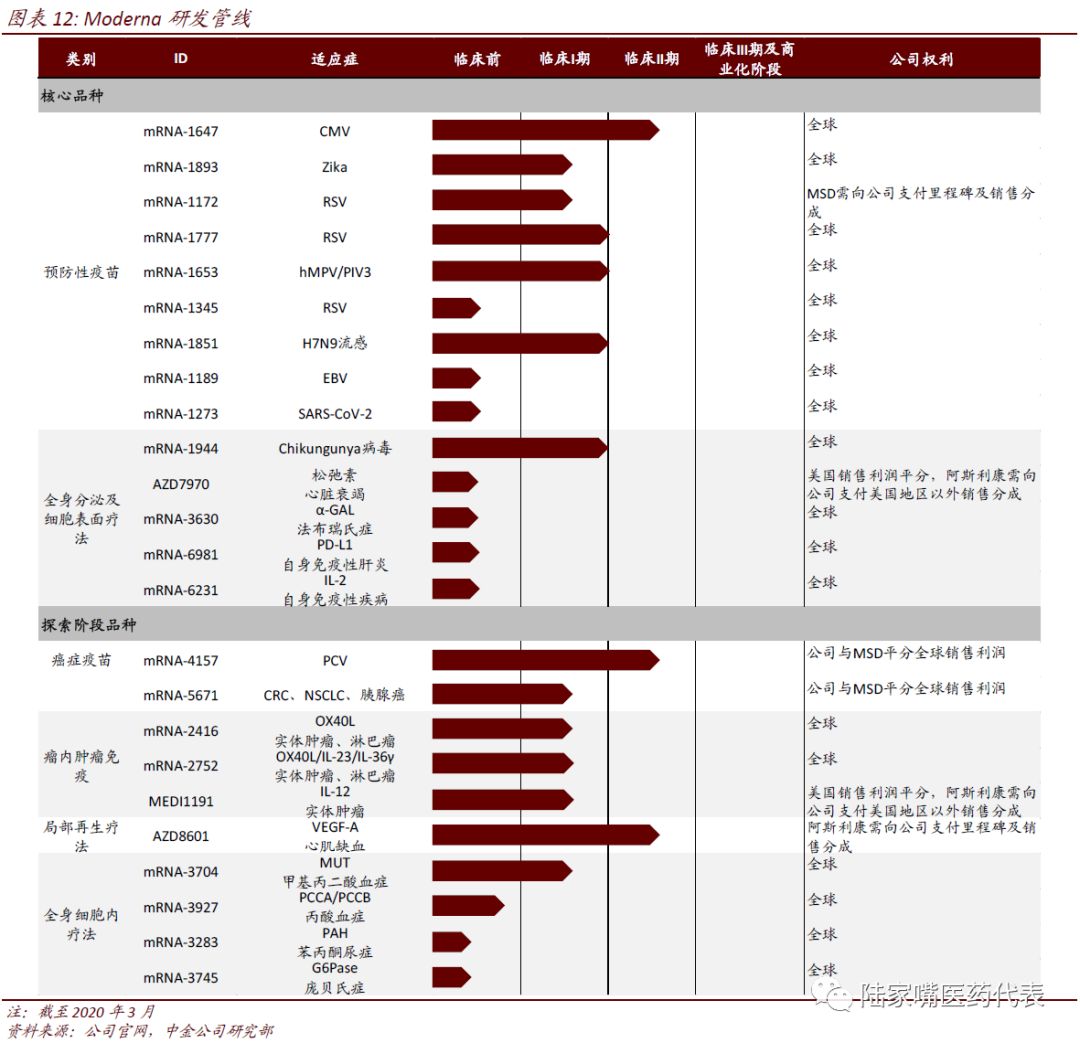
Moderna一直专注于mRNA相关药物和疫苗的研发,现已有成熟的生产设施,公司有丰富的研发管线,现共有24个候选药物/疫苗,治疗领域涵盖了感染性疾病、肿瘤免疫治疗、罕见病、心血管疾病和自身免疫疾病等,14个已经进入临床阶段。公司与AZ、MSD、Vertex等药企建立了研发合作。
公司采用的药物递送技术为脂质体纳米粒(LNP),可以提高mRNA进入细胞和释放至细胞质的效率。公司也开发了一种改进的尿嘧啶核苷酸,可以降低人体固有免疫反应系统对mRNA的识别。公司在mRNA结构元件、核苷酸修饰、药物递送技术等方面均获得了专利。
公司较为领先的CMV疫苗、一款针对黑色素瘤的个性化肿瘤疫苗已经进入II期临床,Moderna两款流感疫苗(H10N8、H7N9)、RSV疫苗、hMPV/PIV3疫苗、COVID-19疫苗、Chikungunya病毒、Zika病毒疫苗以及针对KRAS突变的肿瘤疫苗在I期临床,值得后续跟踪。
BioNTech
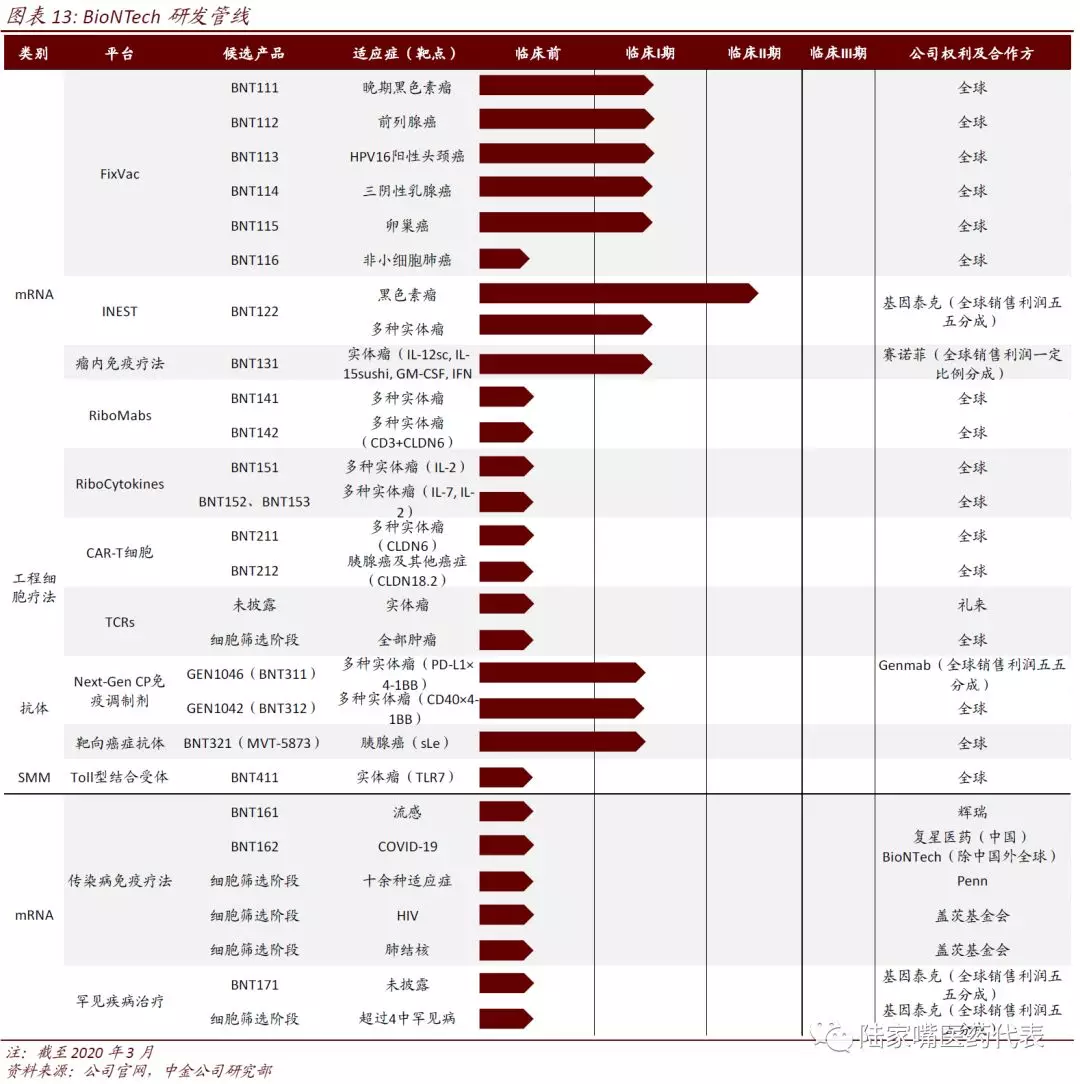
BioNTech也是全球领先的mRNA药物/疫苗研发企业,公司拥有多个技术平台,除mRNA药物/疫苗外,公司还有细胞治疗、抗体药物、小分子免疫调节剂等药物研发平台。BioNTech目前有20余个候选药物,主要关注肿瘤、罕见病和感染性疾病等领域,mRNA药物/疫苗共19个,其中7个进入临床阶段。公司在德国有3个通过GMP认证的生产设施。2020年3月,公司宣布和Pfizer、复星合作开发针对COVID-19的mRNA疫苗(BNT162),预计4月份进入临床。
在mRNA疫苗产品中,公司既有可供不同人使用的通用型肿瘤疫苗,也有针对每个患者的个性化肿瘤疫苗。公司采用的药物递送技术主要为脂质体,包括脂质体复合物、脂质体纳米粒等。公司在mRNA结构元件、药物递送技术方面也都取得了专利。
FixVac:针对突变率较低的肿瘤,多数患者拥有相同的肿瘤抗原,因此公司开发了不同患者均可使用的通用型肿瘤疫苗,一款通用型疫苗含有多个特定的肿瘤抗原组合。基于该技术平台开发的针对黑色素瘤、前列腺癌、HPV16+头颈癌、三阴乳腺癌、卵巢癌等的疫苗已经进入I期临床。
iNeST:针对突变率较高的肿瘤,由于肿瘤突变率较高,不同患者之间异质性较高,因此公司开发了针对特定患者的个性化肿瘤疫苗,先收集患者的标本,进行基因测序并预测出肿瘤抗原,然后合成相应的mRNA。最高可表达20种抗原,针对该技术平台开发的针对黑色素瘤的疫苗已经进入II期临床,多款实体瘤在I期临床。
Intratumoral Immunotherapy:该类mRNA疫苗主要编码细胞因子,在瘤体内注射,可以促进肿瘤组织的固有和特异性免疫反应,改善肿瘤组织的微环境。目前有一款针对多个实体瘤的产品(表达IL-12、IL15、GM-CSF、IFN-α等)进入I期临床。
RiboMabs:该平台是利用mRNA翻译表达蛋白的功能,在mRNA中导入编码特定抗体的序列,利用机体自身细胞生产相应抗体,相比在体外生产抗体药物,该方法无需在体外进行生产、纯化等工作,更加方便。目前该平台产品在临床前阶段。
RiboCytokines:与RiboMabs类似,该平台是针对细胞因子,传统的体内注射细胞因子的方法半衰期短、生物利用度低,该平台利用机体自身细胞产生细胞因子有望解决以上缺陷,可以在感染性疾病、自身免疫性疾病及肿瘤疾病等发挥作用。目前该平台产品在临床前阶段。
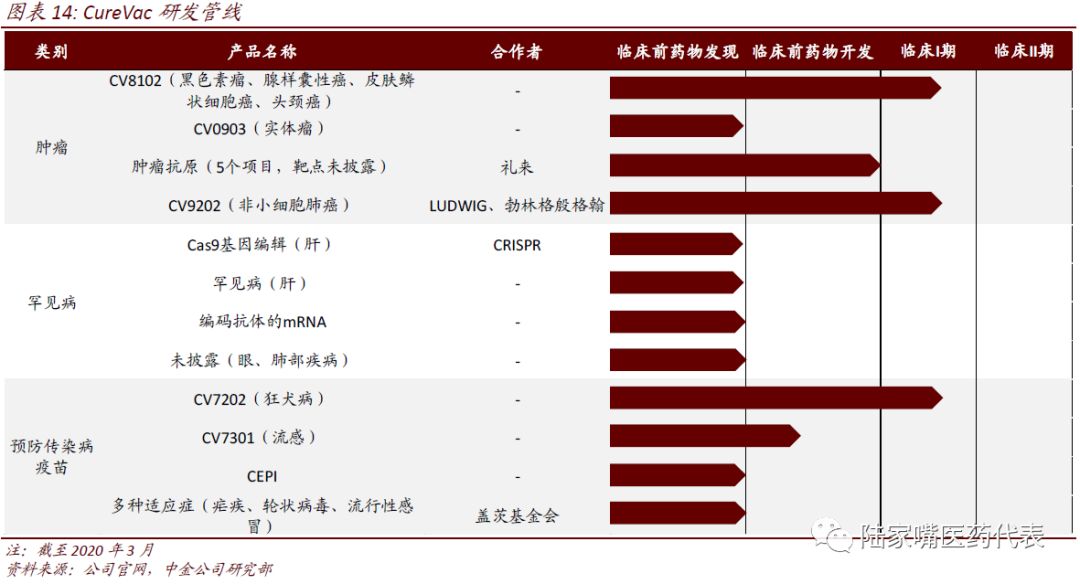
CureVac
CureVac一直专注于mRNA药物/疫苗的研发,主要关注肿瘤、感染性疾病和罕见病。CureVac全球首家建立符合GMP标准的RNA生产线的公司,目前有12个候选药物,3个进入临床阶段。公司与Eli Lilly、BI等大型药企建立和研发合作。
公司最初采用的药物递送技术为鱼精蛋白,但由于效果不佳,后转为脂质体纳米粒。公司在mRNA结构元件部分也取得了专利。CureVac现有针对肿瘤的CVB108、CV9202以及针对狂犬病的CV7202进入I期临床阶段。
应用前景及风险
mRNA疫苗应用前景广阔。理论上mRNA拥有合成任意一种蛋白的潜能,在解决mRNA的稳定性和递送问题后,除了用作疫苗,mRNA也可作为蛋白质补充或替代疗法治疗其他多种疾病,因此,对于传统疫苗无力应对的多种新型病毒、癌症、代谢性疾病等,mRNA疫苗均有巨大的应用潜力。另外在癌症基因测序和抗原新表位发现技术发展的基础上,mRNA疫苗也可以针对肿瘤患者进行个性化治疗。
但mRNA疫苗的发展也存在一些风险。目前mRNA疫苗安全性和有效性的证据多来自动物及体外试验,人体内只有较少的I、II期临床证据,人体环境和动物/体外试验有较大差异,人体内的有效性是否达到理想水平仍有待进一步探索;此外对mRNA的副作用也要密切关注,如局部和全身炎症、药物的生物分布、免疫原的持续表达、刺激抗体的自激活,还有非原生核苷酸及载体引入的成分所具有的潜在毒性等。