本文来自微信公众号“E药经理人”。
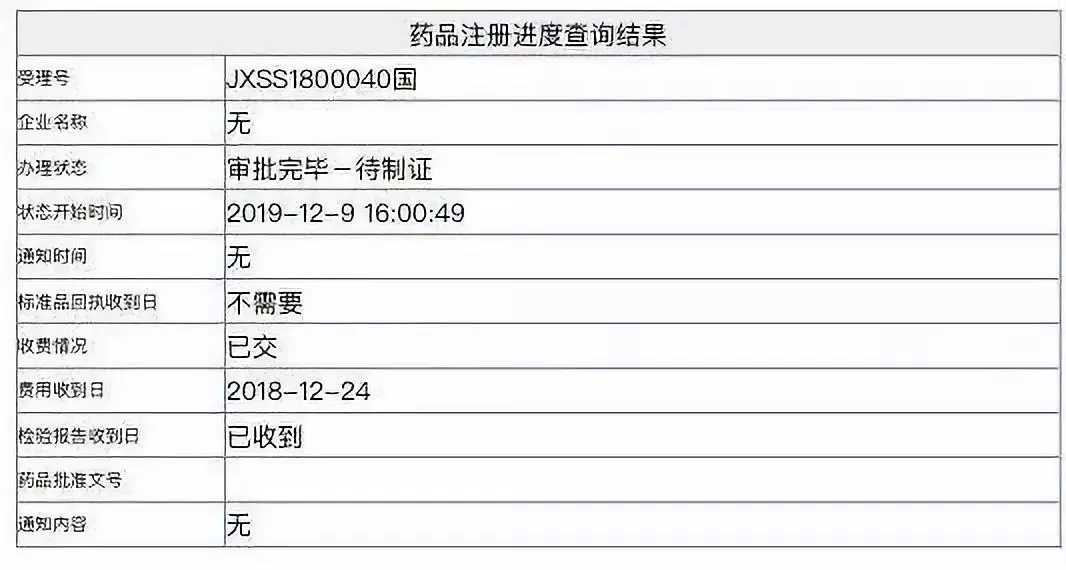
12月9日,国家药品监督管理局批准了阿斯利康(AZN.US)肺癌新药——度伐利尤单抗注射液(durvalumab,英文商品名:Imfinzi,中文商品名:英飞凡)的上市申请,用于治疗同步放化疗后未进展的不可切除III期非小细胞肺癌,成为中国内地获批的第一个PD-L1抑制剂免疫药物,弥补了过去未满足的III期非小细胞肺癌市场需求,或将打开PD-1/PD-L1市场竞争新格局。
阿斯利康对中国这一全球第二大肿瘤市场势在必得。自2017年5月,英飞凡在美国获批上市后,市场份额呈现稳步上升的趋势,2018年2月,英飞凡被FDA批准用于III期不可切除非小细胞肺癌,当年英飞凡全球销售额增至6.33亿美元。刚刚过去的2019年前三季度,增长仍旧持续,英飞凡全球销售额达10.45亿美元,而从阿斯利康2020-2021年临床适应症的布局来看,新适应症的抢夺战才刚刚开始。
英飞凡作为首个PD-L1抑制剂登陆中国市场,将为广大肺癌患者提供新的治疗及用药选择。肺癌是中国发病率和死亡率最高的癌种,过去十年中国的肺癌疾病数据显示,患者年龄呈老龄化趋势,晚期肺癌比例增高,腺癌比例逐渐增高,对中国肺癌预防和控制提出了新的挑战和方向。
而PD-L1免疫抑制剂英飞凡进入中国市场,为中国肺癌患者带来更多临床选择。此次获批的适应症是同步放化疗后未进展的不可切除III期非小细胞肺癌的免疫巩固治疗。
大型III期肺癌临床试验PACIFIC研究结果显示,针对同步放化疗后未进展的不可切除III期非小细胞肺癌患者,接受度伐利尤单抗注射液(英飞凡)免疫治疗的患者3年总生存率已达到57%,预期5年生存率可以达到50%。可以预见,英飞凡获批上市将彻底改变了不可切除III期非小细胞肺癌的治疗模式,为中国III期非小细胞肺癌患者带来临床治愈的新希望。
PD-1/PD-L1单药和复药的研发是肿瘤治疗中最火热的领域,据悉,目前有161项关于探索英飞凡更多突破性的临床试验正在进行,对于适应症的新赛道是现在PD-1/PD-L1抑制剂进行市场竞争的主要方向,先进入赛道者将有更大的优势抢先占据更多市场份额,能更好地应对未来政策及市场趋势的变化。
英飞凡是目前首个也是唯一一个精准抓住III期肺癌细分市场人群定位的肺癌免疫药,在PD-1/PD-L1市场确定了自己的一席之地。
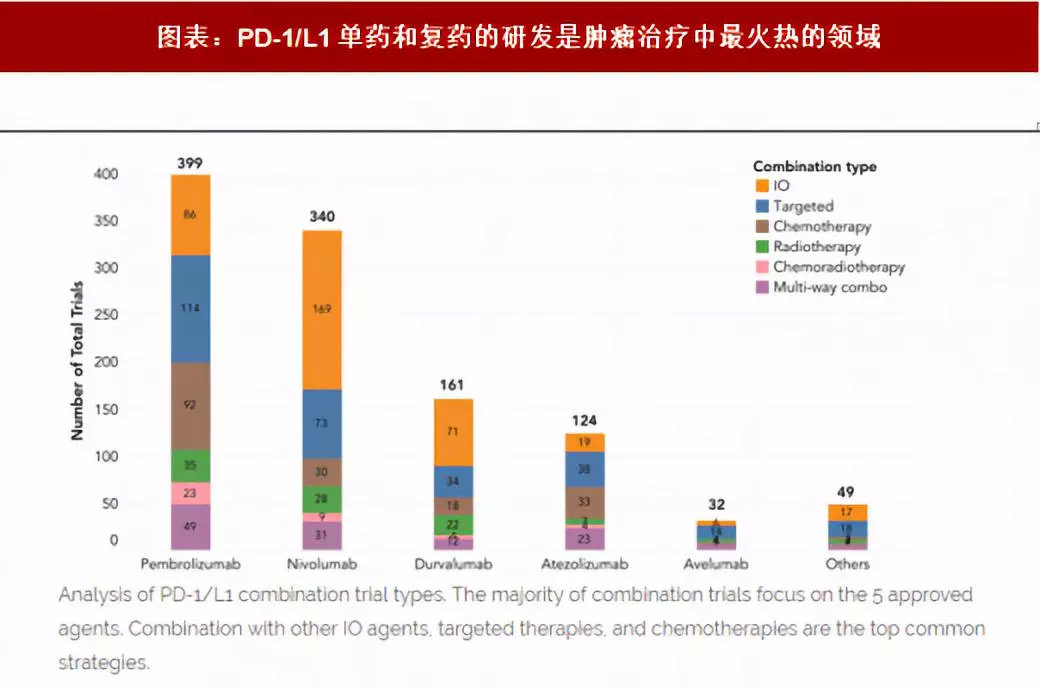
目前全球仍有超过1500项PD-1/PD-L1的临床试验正在进行,其中超过1100个临床试验正在进行将PD-1/PD-L1与其他肿瘤免疫治疗靶点、化疗、放疗或放化疗等联用的联合疗法,联用靶点多达165个。
PD-1/PD-L1单抗治疗的应答率以及耐药情况与肿瘤PD-L1等生物标记物的突变以及肿瘤微环境中CD8+T细胞浸润程度高度相关。联合疗法有望扩大PD-1/PD-L1的适用人群,提高安全性。
除了III期非小细胞肺癌,英飞凡还在探索更多的可能性。在10月刚刚公布的临床试验POSEIDON中,英飞凡将成为一线治疗IV期非小细胞肺癌(NSCLC)的全新疗法,其与化疗构成的组合疗法,及与添加抗CTLA-4抗体tremelimumab的三重组合疗法,相比单独化疗,两种联合疗法对患者无进展生存期(PFS)均带来显著改善。
此外,英飞凡在针对未经系统治疗的广泛期小细胞肺癌(SCLC),也可以显著改善患者总生存期。临床数据显示,对比小细胞肺癌标准化疗,Durvalumab联合4周期的标准化疗(依托泊苷联合顺铂或卡铂),超过三分之一的小细胞肺癌患者18个月后依然健在,对于极度恶性的小细胞肺癌来说是非常有意义的数字。
中国免疫市场迎来新格局
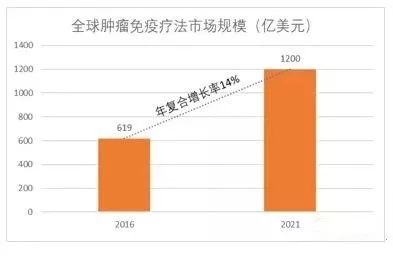
图1 全球肿瘤免疫疗法市场规模(亿美元)(资料:EvaluatePharma)
而中国作为全球第二大肿瘤市场,自然是众多药企的“必争之地”。随着2019年国产PD-1抑制剂的入局,赛道更加清晰起来,2018年中国免疫治疗市场报告预计,先入局的六家企业将占据84%的市场份额。目前竞争格局还在动态变化中,特别是复药在临床的新进展影响着免疫治疗市场的整体局势。
2019年前三季度阿斯利康核心药品销售额排行中,英飞凡排名第七,全球销售额达10.45亿美元,相比2018年同期的3.71亿美元增长180%,市场份额呈不断增长趋势。
此外,2019年前三季度阿斯利康肿瘤领域产品增长幅度54%,总值达63.93亿美元,其中中国区肿瘤领域销售收入10.23亿美元,同比增长67%。可以预见的是,英飞凡在中国获批后,将继续帮助阿斯利康提升在中国市场的业绩表现。
根据第三季度报告显示,阿斯利康将计划2020年完成对头颈部肿瘤、膀胱癌、肝癌的临床试验进行监管提交和验收,也将更多探索非小细胞肺癌(NSCLC)在临床试验中的新用药机会。
从中国市场来看,赛道处于逐步清晰的过程中。过去已获批上市的PD-1抑制剂共有5家,包含2款进口PD-1抗体,3款本土PD-1抗体,已有超过20个国产企业向监管部门提交了临床或注册申请,分别处于不同的开发阶段。阿斯利康此次入局的度伐利尤单抗注射液成为中国上市的第六个免疫抑制剂,也是国内上市的第一款PD-L1免疫抑制剂。
(编辑:孟哲)






