国内生物医药审评趋势向好变化,让生物类似药逐渐成为行业内最炙手可热的“赛道”。正因如此,复宏汉霖(02696)的上市对港股市场而言显得意义非凡。
智通财经APP了解到,5月下旬,复宏汉霖正式启动中国首个生物类似药——汉利康的上市销售。该产品的上市,意味着在生物类似药开发领域,我国生物医药产业已处在从“跟跑欧美”转向“与欧美并跑”的关键节点。
虽然拥有这一重磅产品,复宏汉霖却并未停止开拓的步伐。实际上,汉利康仅仅是其“生物类似药+创新药+联合疗法”研发管线布局中的首款重磅产品。除此之外,该公司还拥有涵盖多达20种以上的生物类似药、候选创新生物药及肿瘤免疫联合疗法的产品管线。
而在生物制药领域,丰富的产品管线往往意味着强大的变现潜力。在这一逻辑下,随着复宏汉霖的核心产品逐步获批上市,公司内在价值也将随之不断增长。
“现金牛”产品不断涌现
一直以来,因技术、资金资源、政策等诸多因素限制,国内迟迟未有生物类似药上市,国内生物类似药产业的发展也长期落后于世界先进水平。如今,这一尴尬局面已被复宏汉霖所打破。
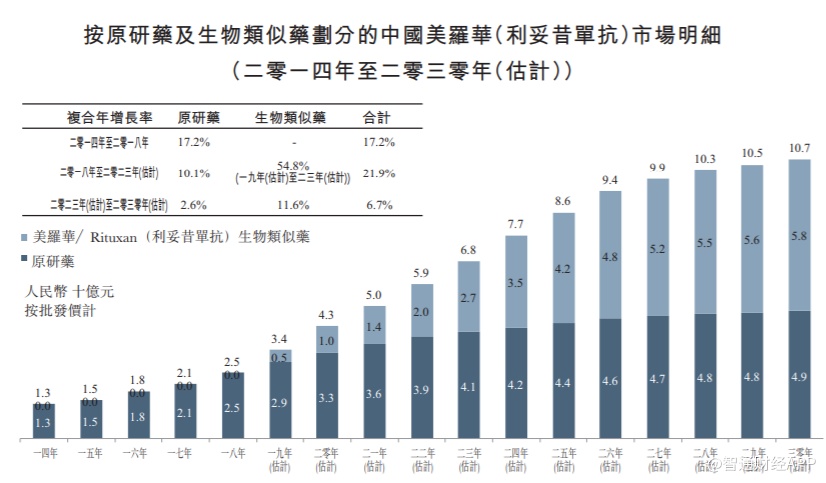
今年2月22日,复宏汉霖研制的利妥昔单抗注射液(汉利康)获批上市,并在此后被火速纳入医保。该药的出现宣告着中国首个生物类似药的正式推出,这也意味着在生物类似药开发领域,我们与欧美先进水平之间的差距已缩短至3-4年。
并且,作为一款拥有近60亿市场规模的药物,纳入医保的汉利康对于复宏汉霖来说,俨然是一款“现金牛”式的重磅产品。
虽有一支“汉利康”在手,但这并不代表复宏汉霖的全部。借助先进且完善的生物药研发体系,复宏汉霖在近10年时间里,几乎每年都有新项目的投入。
尤其是在2012-2014年,公司相继向国家药监局提交了HLX02(针对乳腺癌)、HLX03(针对类风湿性关节炎)及HLX04(针对转移性结直肠癌)等3款新药的临床试验申请,如今这三款新药已成为复宏汉霖商业化进度最快的“现金牛”产品。特别是HLX02产品,更是被投资者视为复宏汉霖下一个阶段接棒汉利康、实现公司持续性规模化变现的新希望。
开启国产曲妥珠单抗新蓝海
赫赛汀(曲妥珠单抗),1998年由Genentech公司研发上市。起初,由于该药针对HER2阳性转移性乳腺癌患者疗效亮眼,一经上市便成为知名抗肿瘤药。而后该药又被批准用于HER2阳性早期乳腺癌患者,这更使其成为了全球内乳腺癌领域的“神药”。
不过,这款“神药”的药价对国内普通患者并不“友好”。智通财经APP了解到,赫赛汀在2002年进入中国。在中国,赫赛汀获批准用于HER2阳性早期乳腺癌、HER2阳性转移性乳腺癌及HER2阳性转移性胃癌的辅助治疗。
虽然该药临床认可度很高,但价格比较昂贵。即使以2018年国家医保目录的数据为准,单瓶440 mg(20mL)赫赛汀的价格也需要7270元,而一瓶仅为一个体重60kg患者的单次注射用量。
据了解,中国新增乳腺癌病例预计将由2018年的约32.07万例增至2030年的约37.32万例。中国胃癌新增病例则将由2018年的44.23万例增至2030年的61.38万例。但是,在这庞大的病患群体中,仅有25%的患者能够负担赫赛汀的费用。
在此背景下,国产生物类似药产品复宏汉霖HLX02的出现显得尤为重要。话虽如此,基于HER2靶点的HLX02药物的研发却并非看上去的那么“轻松”。
该药物的作用机理在于阻断细胞表面的HER2受体接受外界信号,从而阻止或减缓细胞增长,从而达到抑制肿瘤的作用。
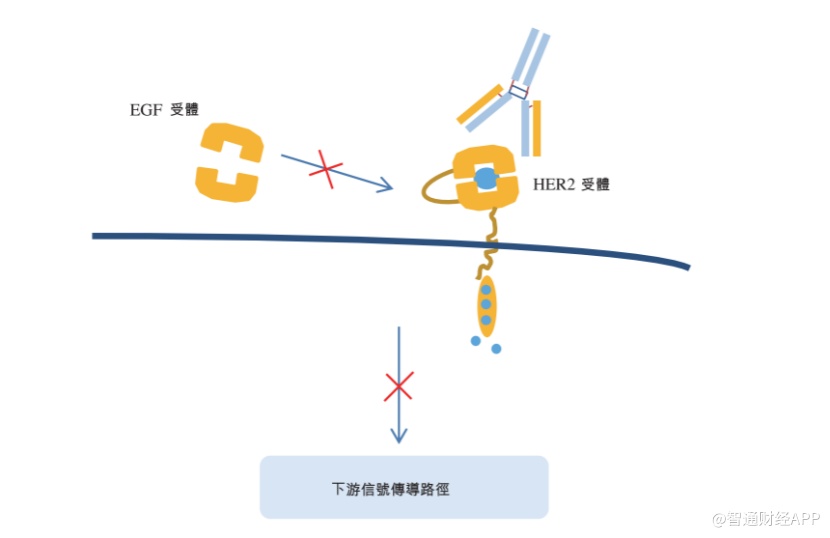
智通财经APP了解到,技术门槛、研发资金投入、研发周期、审批审批速度、以及临床开发中的适应症和临床终点的选择,这诸多因素都可能影响生物类似药的研发难度和进度。
秉承着对病患负责的原则,复宏汉霖针对HLX02产品上进行了大量的研发投入。截至今年5月,公司针对该新药(包括转移性乳腺癌适应症及转移性胃癌适应症)累计投入已达5.6亿元。
以中国市售原研曲妥珠单抗、德国市售原研曲妥珠单抗为对照,HLX02的1期临床试验比较了在受试者中的药代动力学特征、安全性、耐受性和免疫原性。结果显示,HLX02药代动力学与剂量呈现正相关,不同剂量的药物耐受性均为良好,目前该药已被证明与赫赛汀安全性相似且达到PK等效。
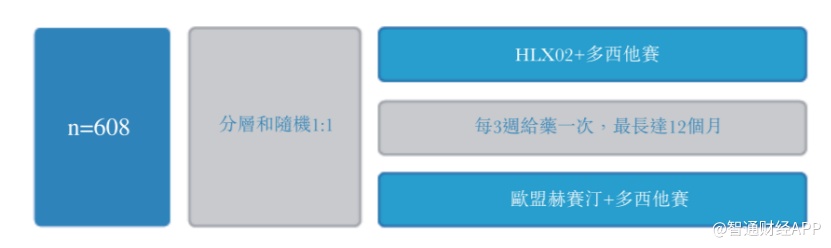
HLX02的3期临床试验则扩大为一项国际多中心、随机、双盲的同步研究,旨在比较HLX02与原研曲妥珠单抗(欧洲市售)在该试验人群中的有效性和安全性。公司共计招募了约608名受试者,且阶段性试验数据已经成功证实在HER2阳性转移性乳腺癌患者中HLX02和原研曲妥珠单抗疗效等效,安全性相似。现试验处于最后随访数据的分析阶段。
实际上,为了更好地布局HER2靶点,在复宏汉霖的研发管线中还有一款同样针对其开发的帕妥珠单抗生物类似药HLX11,以及一种新型HER2抑制剂HLX22。
以HLX22为例,这款新药与其他HER2抑制剂的区别在于其拥有不同靶向的抗原结合位点。并且根据初步临床前研究显示,HLX22与曲妥珠单抗联用可产生协同效应,在肿瘤模型中(用于胃癌)与曲妥珠单抗单药治疗、Perjeta(帕妥珠单抗)(由罗氏开发的抗HER2药物)单药治疗及曲妥珠单抗联合帕妥珠单抗相比,显示出更好的治疗效果。
鉴于此类研究不难看出,在未来,HLX22不仅将作为单药产品在乳腺癌和胃癌的治疗中发挥重要作用,更有机会协同HLX22、HLX11跻身乳腺癌或胃癌领域国际First-in-class的联合治疗方案。
另外,复宏汉霖还在积极探索多元化的以PD-1、PD-L1抗体等为核心的联合疗法组合。基于HLX10(抗PD-1单抗)的作用机制,未来复宏汉霖抗HER2产品HLX02、HLX11和HLX22有望与其共同展开联合疗法,进一步增强其临床疗效,为患者带来更好的治疗方案。
智通财经APP了解到,目前在中国境内上市的曲妥珠单抗注射液仅有罗氏的赫赛汀。数据显示,2018年赫赛汀在中国境内的销售额达到27亿元。与此同时,国内赫赛汀类似药市场预计将在2030年达到73亿元。
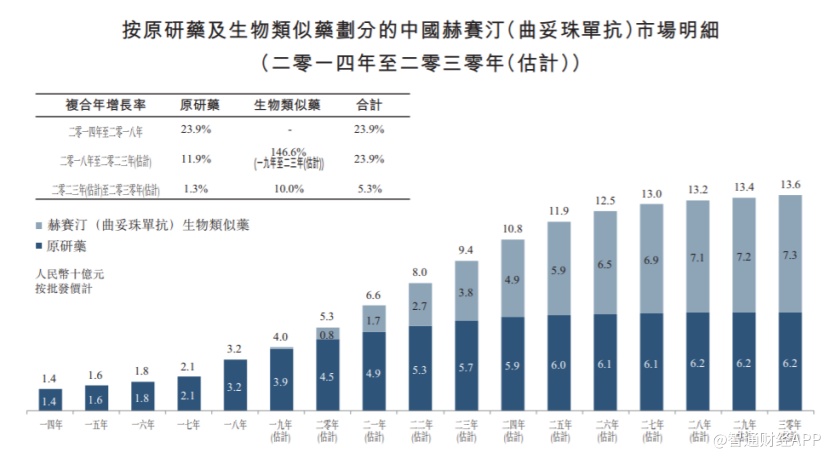
这对于处在国内赫赛汀类似药市场领先地位的HLX02药物而言,一旦能够实现率先上市和国产替换,其市场空间极为巨大,而这无疑将为复宏汉霖开启继汉利康之后新的一片“变现”蓝海。
仿创搭配 完善“变现”体系
其实,除汉利康、HLX02等明星产品外,在“生物类似药+创新药+联合疗法”的布局下,复宏汉霖旗下产品储备已十分充实。
梳理复宏汉霖的产品管线可见,公司不仅有已商业化的HLX01汉利康,还有自主开发的20种以上候选生物药及多种肿瘤免疫联合疗法。
其中2种候选单抗获国家药监局接纳新药药证申请并获得优先审评,1种候选单抗获欧洲药品管理局接纳营销授权申请;2种候选单抗正在进行3期临床试验、6种候选单抗正在进行1/2期临床试验,还有2种正在进行3期临床试验的肿瘤免疫联合疗法;此外公司已在不同司法权区取得30项新药临床试验申请批准。


在丰富的产品管线背后,复宏汉霖充足的研发投入不容忽视。据了解,考虑到资本化以及费用化两方面的研发成本,公司整体研发开支从2017年的6.37亿元增至2018年的9.73亿元,同比增长52.6%;截至今年3月底,公司整体研发开支则达到2.25亿元。
而前期的投入是为了今后的收获。截至目前,复宏汉霖已建成了高效的一体化全球研发平台,并具备了基于健全质量管理体系下的大规模生产能力。
在研发领域,公司已在中国上海、中国台北以及美国加州设立研发中心,并已形成一体化的研究平台。截至今年3月,公司建成了一支拥有239名资深研发人员的团队,其中许多成员都拥有全球大型制药公司的丰富工作经验。
在质量管理领域,复宏汉霖目前已建立了一套健全的质量管理体系,符合美国、欧盟及中国的质量标准,为公司产品今后在多个司法权区及地区的商业化奠定基础。据智通财经APP了解,今年3月,公司的HLX01(汉利康)已取得GMP证书,公司生产基地已具备了GMP认证的生产能力。
在生产领域,复宏汉霖已在上海徐汇基地建成2条产能14000L的生物药独立生产线,包括6台2000升及4台500升的一次性生物反应器及配套纯化设备。作为国内一次性技术的先驱者,尤其是在一次性生物反应器方面,复宏汉霖的一次性生物反应器最多可减少50%资本开支以及25—30%的生产成本,且能省去每次生产周期后的清洗及消毒环节,这将减少每批次的生产时间并降低污染的风险。目前,为支持全球化商业需要,公司正在上海松江建设其第二个商业化生物医药生产基地。
此外,与公司研发和生产体系建设同步推进的还有其全球化商业网络。得益于复星医药优秀的市场准入能力及全国性的销售市场网络,公司将能够实现贯穿各层级市场,将产品在全国范围内深入渗透;在国外市场,复宏汉霖则早已与众多国际伙伴密切合作,签订了相关商业化授权许可协议。
综上所述,复宏汉霖不论从研发平台、产品布局还是到规模化生产和商业化运营都已准备就绪。可以说,目前公司离实现大规模变现的目标仅一步之遥。不难预测,在这生物医药“百花齐放百家争鸣”的当前,富有成长性的复宏汉霖在今后将完全有机会靠着在生物药领域的实力、良好的市场环境,向市场展示自身的潜力与投资价值。




