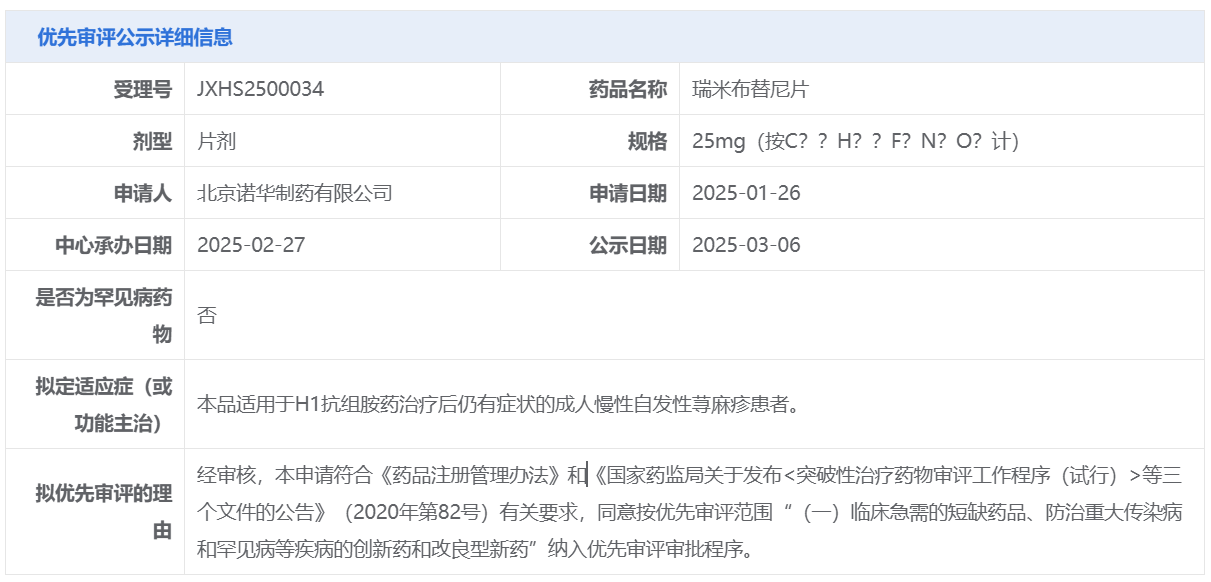
智通财经APP获悉,3月6日,中国国家药监局药品审评中心(CDE)官网公示,诺华(NVS.US)申报的1类新药瑞米布替尼片的上市申请拟纳入优先审评,适用于H1抗组胺药治疗后仍有症状的成人慢性自发性荨麻疹(CSU)患者。这项上市申请此前已于今年2月27日获得CDE受理。
公开资料显示,瑞米布替尼(remibrutinib)是诺华在研的BTK抑制剂,该产品的首发适应症为治疗慢性自发性荨麻疹,针对该适应症的3期临床研究已经取得积极结果,患者最早在接受瑞米布替尼治疗一周后其CSU症状便获得改善,并持续至52周。值得一提的是,这是瑞米布替尼在全球范围内首次申报上市。
CSU是指持续6周或更长时间的慢性荨麻疹,导致该疾病的根本原因是内在因素而非暴露于过敏原或外部诱因,其特征是突然出现瘙痒性风团和/或深部组织肿胀 (血管性水肿,可发生在面部、喉部、手和足) 。
Remibrutinib是一种在研的高选择性共价结合口服BTK抑制剂,可阻断BTK级联反应并抑制导致瘙痒性风团和肿胀的组胺释放。当remiburutinib与标准剂量的抗组胺药联合使用时,会针对炎症通路的两个部分,产生“双管齐下”的效果,针对炎症通路的两个部分,remiburutinib抑制组胺释放,抗组胺药抑制组胺受体,由此减轻CSU症状。





