智通财经APP获悉,近日,全球知名咨询机构Citeline发布《2024年医药研发年度回顾》白皮书(Pharma R&D Annual Review
2024),并评选出全球TOP 25管线规模的制药公司,复星医药(02196)连续第三年入选,位列第17位,较上年度跃升7个名次。
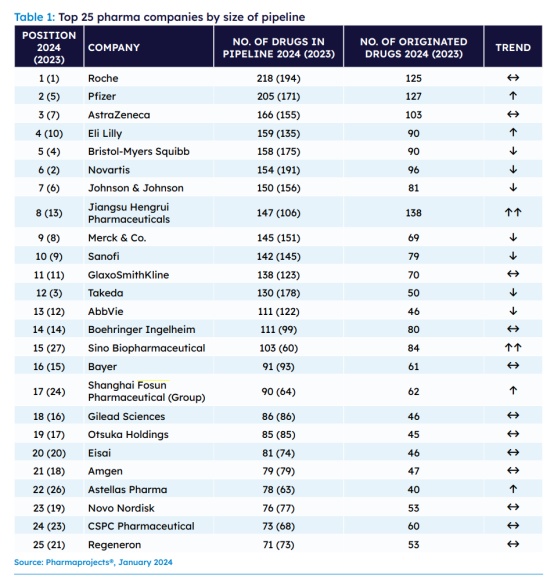
白皮书显示,2023年,全球新药研发管线规模再创新高,中国正不断巩固其世界第二大新药研发的市场地位,中美药企的创新管线规模数量差距正在不断缩小。复星医药作为一家创新驱动的全球化医药健康产业集团,成立30年来,始终坚持以创新作为企业发展的核心驱动力,通过自主研发、合作开发、许可引进、深度孵化的开放式、全球化创新模式,持续丰富创新产品管线。
截至2023年末,复星医药主要在研创新药、生物类似药项目超过70项(按适应症计算)。核心治疗领域聚焦肿瘤(实体瘤、血液瘤)、自身免疫、中枢神经、慢病(肝病/代谢/肾病)等,并重点布局小分子、抗体/ADC、RNA和细胞疗法四大核心技术平台,打造开放式、全球化的创新研发体系,并积极探索肿瘤疫苗、AI药物研发等前沿技术的布局,持续提升核心研发能力和管线价值,以推动更多FIC(First-in-class,即同类首创)与BIC(Best-in-class,即同类最佳)产品的研发及商业化。
2023年,复星医药6个创新药的8项适应症、29个仿制药品种(包括进口注册,但不包括Gland Pharma 获得美国FDA 批准上市的13个仿制药制剂)获批上市;5个创新药/生物类似药共7项适应症、64个仿制药品种(包括进口注册,但不包括Gland Pharma 的海外申报项目)申报上市;此外,获临床试验批准的创新药/生物类似药项目共20项(按适应症计算)。制药板块专利申请达206项,其中包括美国专利申请5 项、PCT 申请11项;获得发明专利授权74项。
研发成果加速兑现 创新产品收入保持快速增长
2023年,复星医药研发投入59.37亿元人民币,同比增加0.88%;其中,研发费用为43.46亿元,同比增加1.02%。截至2023年末,复星医药研发人员超过3,400人,其中超1,800人拥有硕士及以上学位。
近年来,伴随着在创新研发领域的持续投入,复星医药创新研发成果加速兑现,并实现了多个领域从0到1的突破,助力国内医药健康行业的持续高质量发展。
截至2023年末,复星医药已自主研发并上市国内第一款生物类似药汉利康(利妥昔单抗注射液);合营公司复星凯特国内上市的第一款CAR-T药物奕凯达(阿基仑赛注射液),填补国内相关领域的市场空白,奕凯达亦于2023年6月新增获批二线适应症,将惠及更多一线免疫化疗无效或复发患者。
自主研发的首款创新生物药抗PD-1单抗汉斯状(斯鲁利单抗注射液)成为全球首个获批用于一线治疗广泛期小细胞肺癌(ES-SCLC)的靶向PD-1 单抗药品,此外,斯鲁利单抗注射液(PD-1 抑制剂)亦已获印度尼西亚食品药品监督管理局(BPOM)批准用于治疗广泛期小细胞肺癌(ES-SCLC),系该产品首次于海外市场获批上市,也是首个在东南亚国家获批上市的国产PD-1 单抗。
2023年,包括汉斯状(斯鲁利单抗注射液)、注射用曲妥珠单抗(中国境内商品名:汉曲优)、苏可欣(马来酸阿伐曲泊帕片)等在内的重点品种收入保持快速增长。
多款在研管线快速推进 覆盖中美欧三大核心市场
当前,复星医药多项在研管线快速推进。2023年,复星医药自主研发、合作开发及许可引进的5个产品共7项适应症进入上市前审批阶段。
其中,斯鲁利单抗注射液(PD-1抑制剂)于欧盟的上市许可申请(MAA)获受理,该产品第5项适应症一线治疗非鳞状非小细胞肺癌(nsNSCLC)的上市注册申请也已获国家药品监督管理局受理。自主研发的注射用曲妥珠单抗(中国境内商品名:汉曲优)用于治疗乳腺癌的上市许可申请已获美国FDA受理,并有望成为首个在中国、欧盟、美国获批的国产生物类似药,进一步覆盖欧美主流生物药市场。2024年4月,复星医药自主研发的MEK1/2 选择性抑制剂FCN-159拟纳入优先审评,针对适应症为治疗成人树突状细胞和组织细胞肿瘤。
复星医药许可引进并经后续自主研发的创新型定点抗体偶联药物FS-1502(注射用重组HER2人源化单克隆抗体单甲基奥瑞他汀F偶联剂)用于治疗HER2阳性不可手术切除的局部晚期或转移性乳腺癌于中国境内启动III期临床研究。
同时,复星医药持续推动管线内疫苗的研发和产业化落地。2023年4月,复星医药自主研发13价肺炎球菌结合疫苗已完成III期临床入组。2024年3月,复星医药自主研发的冻干人用狂犬病疫苗(Vero细胞)已于中国境内获批上市。
此外,包括DaxibotulinumtoxinA型肉毒杆菌毒素(项目代号:RT002)、盐酸替纳帕诺片(项目代号:Tenapanor)及注射填充产品Profhilo(即注射用透明质酸钠溶液)在内的多款在研产品在中国境内的上市申请获国家药监局受理。
未来,复星医药将始终以患者为中心,围绕未被满足的临床需求,持续加强创新投入,高效推进全球领先技术和创新产品的研发和转化落地,积极探索并推动源头创新成果转化,致力于成为全球医疗健康市场的一流企业,引领医药行业高质量发展。