本文来源于“EBoversea”微信公众账号,作者为光大海外医药分析师团队李君周、吴佳青。
【摘要】
美股制药企业:创新研发的沃土中成长:国外对于创新药物研发的制度环境良好,药物上市后丰厚的收益激发制药企业研发热情。大市值药企如辉瑞、吉列德通过并购丰富产品组合获得成长,中型药企如因赛特医疗、亚力兄制药通过自我研发创造具有核心价值的药品,新晋的小型生物制药企业虽未盈利,其研发管线被二级市场给予估值。国外的创新药物研发对于中国新药研发之路具有借鉴意义。
我国创新药研发时代来临:规模虽小、增速较快:从产业层面来看,中国新药研发十余年积累已逐渐进入收获期。2015年以来政策密集发布,制度环境优化,保障了创新药产业的长期发展。我们认为创新药研发时代已经来临,药物研发逐步与国际接轨,国内制药产业核心将向创新药转移。从长远看,创新药研发的沃土将会孕育具有强大研发能力和丰富研发成果的制药巨头。
港股上市新规有望使研发型药企估值体系得到重估:随着港股医药公司不断增加投入布局在研管线、港交所拓宽新规允许未盈利的生物科技企业赴港上市,二级市场对于在研管线的合理估值尤为重要。对比国际生物制药行业及金融机构对于药物研发项目的评估方法,我们认为风险修正的现金流折现法更适用于港股研发型药企的估值。我们构建了适用于在研药物估值的rNPV估值方法,以中国生物制药的重磅在研品种安罗替尼为例,估算该品种二级市场估值近90亿港币。医药企业估值体系有望从PEG估值走向PEG+在研管线折现估值,新的估值体系更适用于研发型药企。
投资标的:我们看好具有创新研发管线的中国制药企业,对应公司分别为港股研发标杆、在研管线雄厚的中国生物制药;拥有四大研发平台、整合全球资源的绿叶制药;业务板块逐步丰富、布局生物药研发的三生制药;从原料药生产厂商向高端创新药积极迈进的石药集团;研发与代理双轮驱动的李氏大药厂和单抗、微球平台布局全面的创新药生产厂商丽珠医药。
风险分析:行业政策推行的不确定性、临床实验失败的风险、研发进度不及预期的风险、医保和招标降价风险。
【正文】
美股制药企业:创新研发的沃土中成长
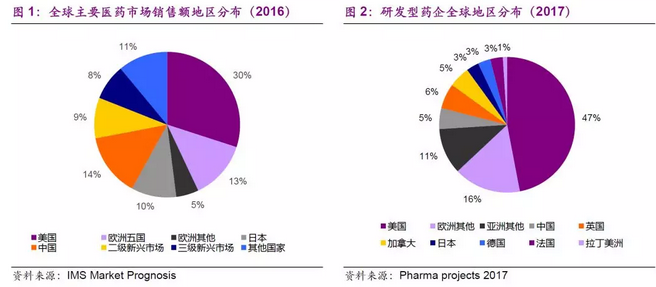
一直以来,美国在生物医药及其产业化方面占据着世界领先地位,生物医药产业成为美国高技术产业发展的核心动力之一。生物医药产业是美国新型的技术密集型产业也是美国经济发展的支柱型产业,有着举足轻重的影响力。作为全球生物医药发展的中心,已经形成了波士顿、圣地亚哥、旧金山、华盛顿、北卡三角园五大生物医药产业基地。美国生物医药产业蓬勃发展,拥有世界上约一半的生物医药公司和一半的生物医药专利,医药销售额占全球生物医药产品市场的30%以上。
制度及政策激发药企研发热情
美国生物医药产业蓬勃发展,得益于本国众多世界一流大学培养的优秀人才以及联邦政府支持的科研院所积极开展的各项促进医学进步的基础研究。此外,国会和联邦政府制定的多项政策也是美国生物医药产业发展的重要推手和制度保障。
20世纪80年代以来,美国国会通过一系列的立法,为美国医药产业创新保驾护航。《Bayh-Dole法案》明确科研机构对研发成果专利权的主体地位,同时发明人有权享有部分技术转让收益。法案激发了科研工作者研发创新药的热情,促进科研成果向产业界转化。《Hatch-Waxman法案》平衡了创新药和仿制药的利益关系。法案通过专利期限补偿制度和数据保护制度延长产品专利期,同时给予不与专利期叠加的市场独占期,调动药企研发积极性。《PDUFA法案》又名《处方药申报者付费法案》,通过向药企收费的方式,在不增加财政支出的情况下,加强了审评人员队伍建设,在保证新药审评高质量高标准的前提下,提高新药审评效率。
FDA提出了加速审评(Accelerated Approval)的鼓励措施,根据不同的特点,申请人可以按照三种通道提交申请资料。美国食品药品管理局(FDA)是国际医疗审核权威机构,由美国国会即联邦政府授权,专门从事食品与药品管理的最高执法机关。FDA的药物政策侧重于鼓励制药企业进一步研发新药,保障罕见病患者获得药物的权益。在新药注册审评方面,对于有前景的治疗方法、治疗严重疾病、可以提供治疗上的益处的药物,提出了3项措施。
快速通道(Fast Track),旨在加快对治疗严重疾病的药物的审评审查,并根据临床试验数据填补未满足的医疗需求。快速通道可以让病人更早获得重要的新药,药品公司可以主动提出快速通道要求。
突破性疗法(Breakthrough Therapy),突破性疗法旨在加速开发和审查一些用于治疗严重疾病的药物。如果初步临床证据能够表明某药物可能比现有疗法有明显改善,则药品公司可以主动提出突破性治疗方案申请。
优先审评(Priority Review),优先审评意味着FDA可以在6个月内对一个申请进行审批,而在标准审查一般是10个月。一项优先审查的申请通常用于评估可显著改善治疗、诊断或预防严重疾病的药物。
成功的创新药研发为企业带来丰厚收益
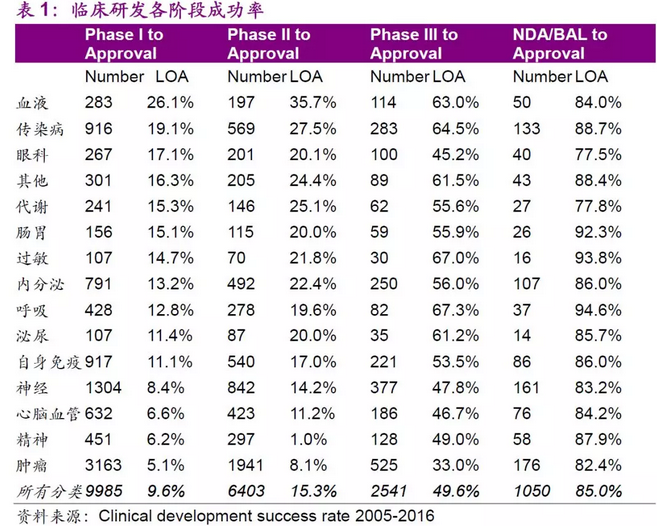
创新药物研发难度大、研发成功率低。根据BIO(Biotechnology Innovation Organization)、Biomedtracker、AMPLION等三个机构联合出品的《Clinical Development Success Rates2006-2015》,对2006-2015年临床阶段的在研新药进行了成功率的统计与分析。不同药物和不同适应症的平均研发成功率,临床I期的成功率在63.2%,II期临床成功率低到30.7%。从临床I期到最后通过批准上市的总成功率仅为9.6%。
新药研发的时间较长。根据药物研发的各个阶段,可以将其分为临床前药物发现、新药临床申请、临床试验(I期、II期、III期)、新药申请、批准上市等若干个阶段。
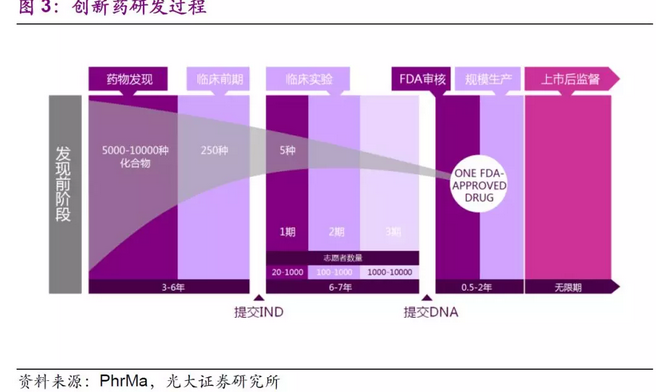
临床前试验:将一个新发现的化合物经过实验室和动物试验,证明该化合物针对特定目标疾病具有生物活性,通常需要3~6年时间。
新药临床研究申请:当一个化合物通过了临床前试验后,需要向FDA提交新药临床研究申请,以便可以将该化合物应用于人体试验。
一期临床试验:这一阶段的临床试验一般需要征集20-100名正常和健康的志愿者进行试验研究。主要目的是提供该药物的安全性资料,包括该药物的安全剂量范围。这一阶段通常需要1~2年时间。
二期临床试验: 这一期的临床试验通常需要征集100-500名相关病人进行试验。其主要目的是获得药物治疗有效性资料,通常需要1~2年时间。
三期临床试验:这一期的临床试验通常需 1000-5000名临床和住院病人,多在多个医学中心进行,在医生的严格监控下,进一步获得该药物的有效性资料和鉴定副作用,以及与其他药物的相互作用关系。第三期临床试验是整个临床试验中最主要的一步,通常需要1~2年时间。
新药申请:在完成所有三个阶段的临床试验并分析所有资料及数据,如证明该药物的安全性和有效性,则可以向 FDA提交新药申请。按照法规,FDA应在6个月内审评完新药申请。
批准上市:一旦FDA批准新药申请后,该药物即可正式上市销售,供医生和病人选择。但上市以后对于有些药物FDA还会要求做第四期临床试验,以观测其长期副作用情况。
尽管创新药物研发的难度之大,各个阶段的通过率非常之低,但每年全球的研发管线中的药物数量却在蓬勃发展之中,2017年全球研发管线中的药物达到了14872个药物。这与全球范围内各大药企对于研发投入的热情和力度有着直接的关系,创新药物研发成功以后将为企业带来丰厚的收益。
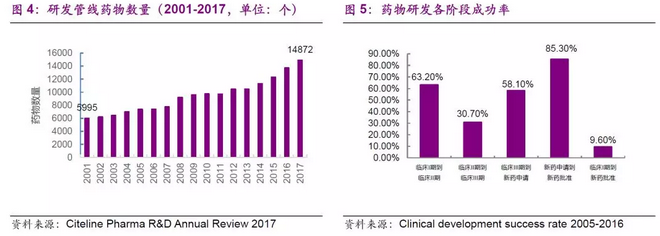
创新药物研发为企业带来的收益丰厚。18年1月,美国制药公司AbbVie公布2017年业绩,全年实现净收入282.16亿美元,增长10.1%。其中Humira(阿达木单抗)取得了184.27亿美元的成绩,成为了2017年全球药品销售冠军。这也是Humira自2012年接棒波立维之后连续第6年荣膺全球“药王”。
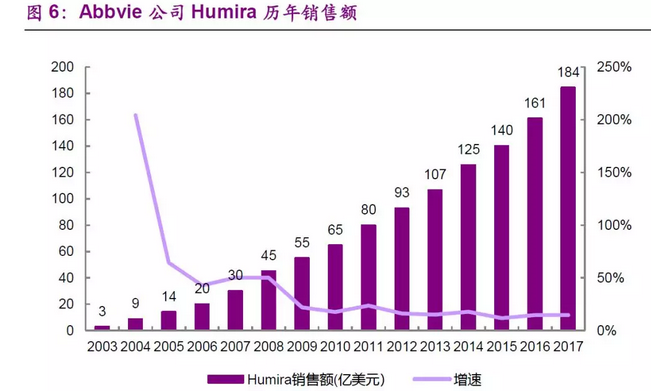
自2013年以来,FDA每年批准20~50个药物不等,其中不乏一些制药巨头的重磅产品,如13年上市的吉列德科学的丙肝药物Sovaldi和百健公司Tecfidera预测销售峰值可达123亿美元,14年上市的2014年百时美施贵宝的首款PD-1抑制剂Opdivo预测销售峰值可达198亿美元。
美股制药板块:强劲的研发管线和并购举措推动市值扩张
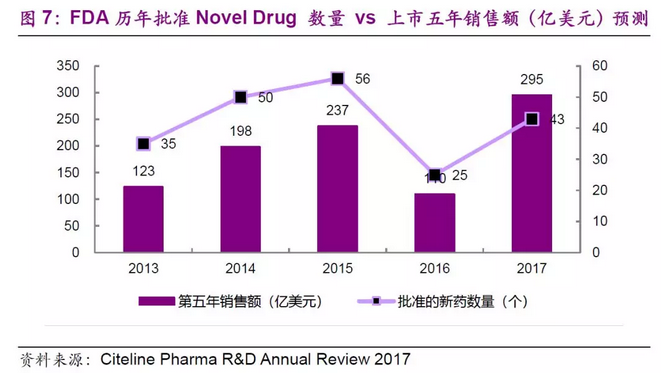
美股制药板块市值向龙头集中的现象较为明显。根据Bloomberg统计,截至2018年1月30日,按照500亿美元和100亿美元为市值划分区间,制药板块500亿美元以上市值公司约16 家,占美股制药板块公司数量2.6%,但市值占比达到了68%,创造了19648亿美元的市值。100-500 亿美元市值公司共有19 家,市值占比在16%左右,创造了4573亿美元的市值。前35家100亿美元以上市值的公司,只占美股制药板块5.7%的公司数,总市值达到了2.4万亿美元,占了制药板块84%的市值。
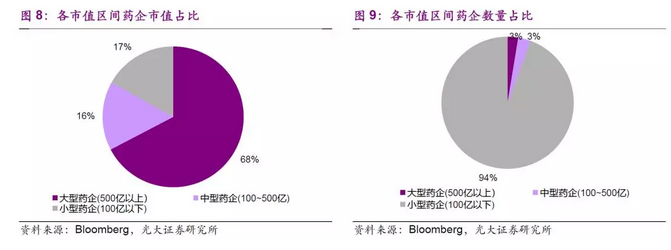
仿制药价格下滑,非专利型仿制药企市值较小。根据彭博统计的非专利型制药企业市值排行(截至18.2.1),前6家企业来看,市值扩张速度则慢很多,同时最大的非专利型药企的迈兰实验室市值仅为256亿美元,远不能与大型专利型制药企业相比。
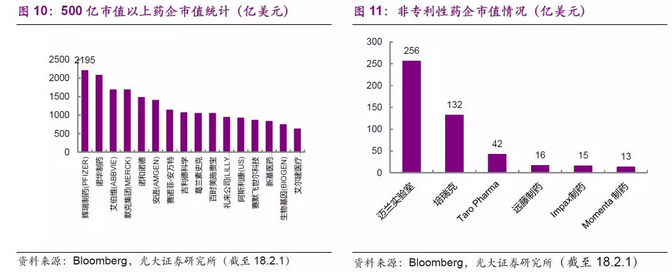
FDA审评加速,2017年美国FDA批准了过去五年数量最多的仿制药上市申请,截至2017年12月中旬,美国FDA共批准了765个仿制药,远超2016年的630个。药品审评加速之后是仿制药面临的降价压力,部分产品在已经饱和的市场中不再有竞争力,仿制药企业的前几大企业都面临着严峻的降价压力,而不得不采取精简运营等措施。在FDA现有的审评体制和审评速度之下,预计未来仿制药的降价压力将会有增无减。根据板块制药企业市值统计来看,反观大型专利药企市值扩张较为迅速,一方面研发管线产品上市,产品管线不断丰富,另一方面,大型药企并购能力较强。
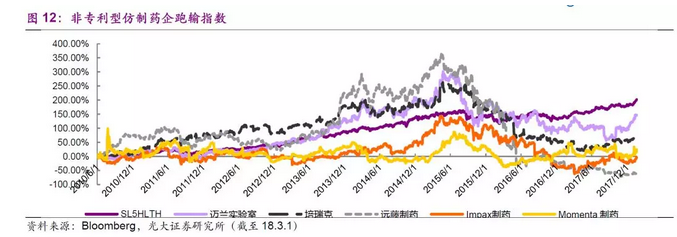
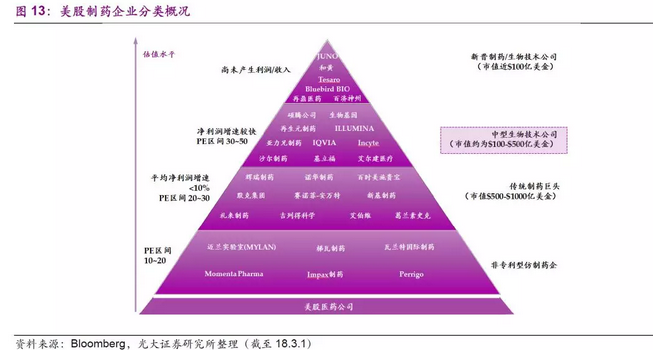
从美国制药板块的估值水平来看,非专利型仿制药企业的PE(TTM)区间在10~20之间,传统的制药巨头如辉瑞、诺华、百时美施贵宝等药企市值区间为500~1000亿美元,企业的平均净利润增速小于10%,PE(TTM)区间在20~30之间。估值较高的是一些中型的生物技术公司,市值区间在100~500亿美元之间,多数公司由几款核心产品支撑,净利润增速较快,PE(TTM)区间在30~50之间。值得一提的是,美股制药板块一些新晋的制药和生物技术公司,在研发方面投入较高,在研产品均是一些新型的药物或疗法,尽管公司尚未产生产品利润或收入,但是市值已经接近几十甚至百亿美元。
重磅产品管线推动大型药企成长
大型制药企业多通过自我研发或并购获得重磅核心品种,产品管线驱动大市值公司成长。
吉利德科学公司(Gilead SciencesInc)创立于1987年,公司是全球最大的抗艾滋病毒药物制造商。
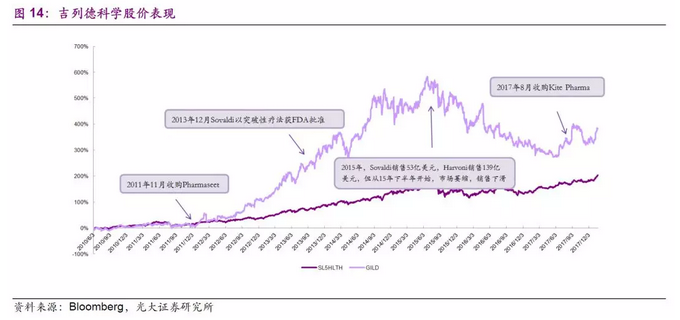
2011年11月21日,吉利德科学公司110亿美元购买丙型肝炎病毒治疗药生产商Pharmasset公司。通过收购,吉利德获得了3个潜在的口服丙型肝炎病毒治疗药物, Sovaldi、Harvoni和 Ledipasvir,将治疗丙型肝炎抗病毒药物的市场从注射剂转移到口服给药。 Sovaldi,适用于基因2、3型HCV患者,一个疗程(12个星期)8.4万美元。2013年12月上市,2013年销售收入1.39亿美元,2014年销售收入102.63亿美元, 2015年销售收入下跌至52.76亿美元。Harvoni,则适用于基因1、4-6型患者,是Sovaldi与Ledipasvir二联复方组合,一个疗程(12个星期)9.45万美元。2014年10月上市,2014年销售收入21.27亿的美元,2015年销售收入达到了138.64亿美元。
从收购Pharmasset到2015年可以说是吉列德科学市值大幅扩张的4年,而市值扩张的背后主要是由Solvadi和Harvoni两款药物的销售产出所支撑,这两款药物分别位居2015年全球畅销药物的第2位和第13位。而后由于市场的萎缩和印度仿制药企业的冲击,销售额逐渐下滑,也导致了公司的股价下跌。
但吉列德公司的收购之路也不止于此,2014年,吉利德以6亿美元收购PI3K抑制剂Idelalisib,该产品后被FDA同一天同时批准用于3种血癌的治疗。2015年1月,吉利德宣布以4.7亿美元收购德国生物制药公司Phenex,当时Phenex最重要的资产是处于II二期临床试验阶段的法尼酯X受体激动剂PX-104,主要适应症是非酒精脂肪肝(NASH),同一机理在代谢疾病领域有很多其它潜在用途。2015年12月,吉利德以20亿美元高价收购Galapagos公司JAK抑制剂,该产品仅需口服,相比于其他抗TNF药物通常以皮下注射的给药方式,其优势不言而喻。2017年8月,公司以119亿美元收购专注研发Car-T的Kite 制药,同年10月,美国食品和药物管理局(FDA)已批准嵌合抗原受体T细胞疗法(CAR-T)Yescarta用于既往接受二线或多线系统治疗的复发性或难治性大B细胞淋巴瘤(DLBCL)成人患者的治疗。
中型创新药企产品多为重磅领域的重磅单品
制药板块的中型药企多数为创新型药企且有已上市的品种,研究领域集中于一些热门大病种领域,产品大部分处于生命周期的早期,仍有较大的发展潜力,净利润增速较快。
福泰制药(Vertex)专注肿瘤新型小分子药物研发,目前已有三种药品上市,分别为Kalydeco(Ivacaftor),Orkambi(Lumacaftor/ivacaftor),Incivek(Telapravir),主要用于治疗囊性纤维化病,2016年,Kalydeco和Orkambi分别实现收入703.4百万美元和979.6百万美元,两款药物占公司销售收入的99.9%。
因赛特医疗专注研发艾滋病、癌症和炎症药物,目前有两种药品上市,分别为Jakafi(鲁索替尼)和Iclusig(普纳替尼)。Jakafi是FDA批准的首个治疗骨髓纤维化的药物,其主要成分是一种蛋白激酶JAK1和JAK2的小分子抑制剂。2016年Jakafi实现销售收入8.54亿美元,占公司销售收入的96.6%。
亚力兄制药专注心血管疾病、免疫系统疾病以及神经系统疾病药品,目前共三种产品Soliris(依库丽单抗),Strensiq (asfotase α注射剂),Kanuma(sebelipaseα注射剂)。2016年,Soliris 实现销售收入28.43亿美元,Strensiq实现销售收入2.10亿美元,2种产品占公司销售收入的99.1%。
除去已上市的产品,这些中型创新药企业均有自我研发管线,不断投入研发、开发针对重磅疾病领域的新型药物。
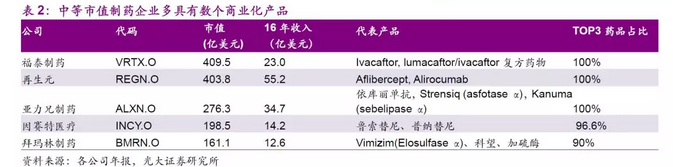
小型新晋生物制药企业股价受临床研发进度影响大
小型生物制药企业研发管线具有较高估值。受益于美国波士顿、圣地亚哥、旧金山、华盛顿、北卡三角园等生物医药产业基地的孕育,美股制药板块还有很大一部分小型生物制药公司,这一类公司尚未盈利或者刚刚开始盈利,前期投入了较大的资金和时间进行药物或疗法的临床研究,但市场对这些药企的在研管线仍给予了较高的估值。对于这些初创型的生物技术公司,FierceBiotech每年发布的全球生物技术初创公司Fierce 15,这一项评选已经持续多年,榜单可参考性极高。
这一类新兴的制药企业股价受临床试验过程中负面消息的影响更为深重。CAR-T,嵌合抗原受体T细胞免疫疗法,近几年被改良使用到临床上的新型细胞疗法,在急性白血病、非霍奇金淋巴瘤、多发性骨髓瘤等疾病领域的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。2017年可以说是CAR-T疗法的元年,有两款CAR-T药物成功上市。诺华的Kymriah,17年8月被批准用于治疗2至25岁的B细胞急性淋巴性白血病复发或不符合标准治疗的患者,疗程定价47.5万美元。17年8月,吉利德以119亿美元收购KITE Pharma,不到2个月后,Kite Pharma的Yescarta被批准用于两次治疗失败后的成人B细胞淋巴瘤患者,疗程定价37.3万美元。
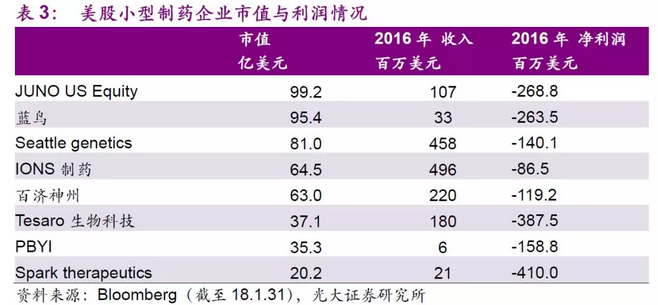
诺华、KITE(17年8月被吉列德科学收购)、JUNO(18年1月被Celgene收购)、Bluebird等公司是目前国际上对于多个靶点有布局的第一集团。Bluebird公司在14年美国血液病年会上宣布公司治疗 地中海贫血症患者的基因疗法具有显著临床效果后股价迎来暴涨,然而次年6月,临床结果表明该疗法有猝死可能性后,股价暴跌。此后公司专注于BCMA靶点的CAR-T疗法bb2121,随着该项疗法的临床结果不断披露,公司目前市值近94亿美元,值得注意的是公司目前处于临床研发阶段的项目共有5个,尚未有成功上市的产品。
中国创新药研发时代来临:规模虽小,增速较快
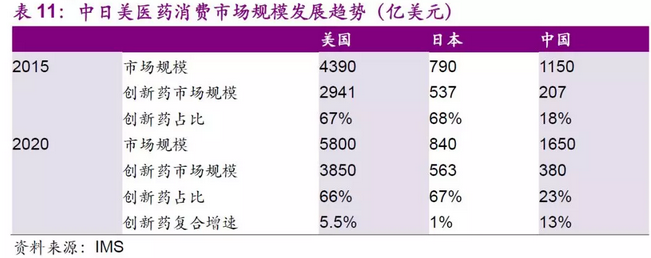
据IMS Health 统计,2015 年美国医药市场规模为4390 亿美元,其中创新药占比67%;欧洲市场1440 亿美元,创新药占比60%,日本市场规模为790 亿美元,创新药占比68%;而中国市场规模约1150 亿美元,创新药占比不足20%,远低于世界发达国家地区。目前的中国药品结构以Me-too类仿制药为主,对标成熟的药品市场,IMS Health预计到2020 年,中国医药消费市场规模可达到1500-1800 亿美元,创新药占比23%,仍低于全球发达国家地区。
产业层面:十年投入,已逐渐进入创新药收获期
2008年,国家出台“重大新药创制专项”政策,从政府层面对创新药予以大力扶持,对医药行业创新升级影响尤为深远。此后通过千人计划引进国际人才,晨兴创投、礼来亚洲等投资机构大量介入创新药投资。
2011年以来,医保控费和招标降价成为行业的关键词,仿制药及无效辅助用药的市场空间逐渐减小,制药企业开始谋求转型,积极投入创新药物研发。
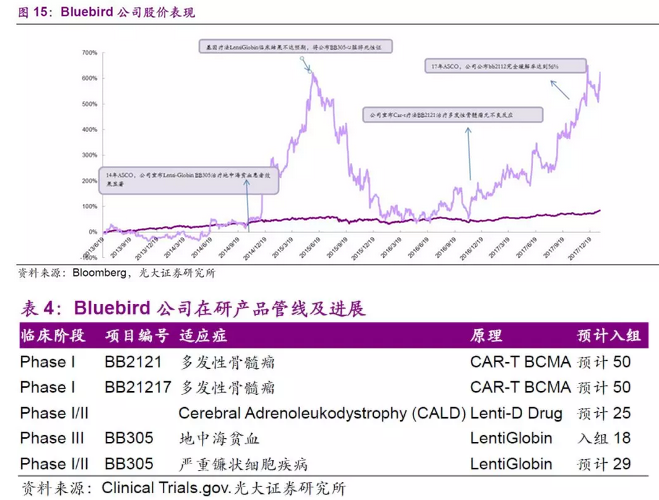
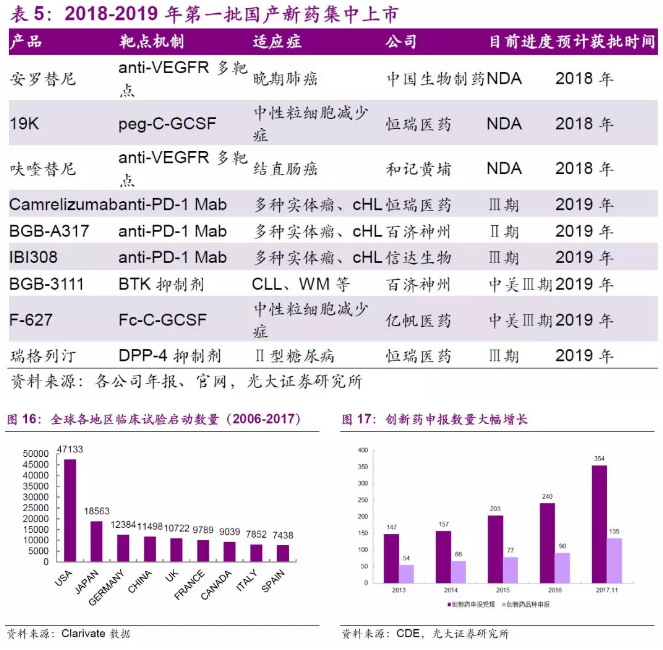
在这一大背景下,中国启动的临床试验数量也从2007年的293个迅猛增长至2016年的1398个,在全球排名第4(前3位分别是美国、日本和德国),在新兴市场遥遥领先。根据国家食品药品监督管理总局药品审评中心的数据显示,17年以来新药批准数量不断攀升,远超16年同期,我们认为创新药十年投入已逐渐进入收获期,从目前药物研发进度来看,我国2018-2019第一批的国产新药阶段性集中上市。
制度环境大大优化,为创新留足空间
2015年以来,为加快我国创新药产业发展速度国务院及食药监局出台系列相关政策以改革药品审评审批制度,政策环境为创新药提供沃土。
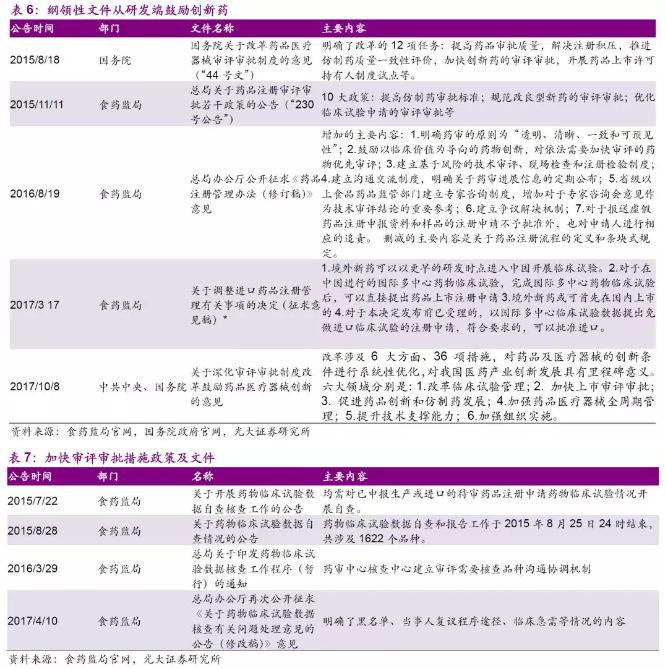
出台多项纲领性文件从研发端鼓励创新药。15年8月,中共中央国务院印发了《关于改革鼓励药品医疗器械审评审批制度的意见》,该《意见》提出了加快药品审评审批速度、提高仿制药质量、鼓励研究创新药等5大目标,并提出了具体的细分改革措施,并在自15年以来的2年之间不断跟进具体政策措施。改革后的药审制度从研发端鼓励优质创新药。17年上半年,食药监局出台了一系列文件鼓励药品器械创新,与国际接轨。17年10月,中共中央国务院印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出了改革临床试验管理、加快上市审评审批、促进药品创新和仿制药发展、加强全生命周期管理、提升技术支撑能力和加强组织建设六大方面共36项措施。随后,食药监局相继发布《药品注册管理办法(修订稿)》、《〈中华人民共和国药品管理法〉修正案(草案征求意见稿)》。
出台大量政策,加快审评审批速度,目前已经消除药品注册积压。2015年之前,我国药品审评审批存在大量积压,一款药品上市过程中大量的时间花在排队过程中。为解决申请积压问题,总局一方面扩充审评人员队伍,另一方面开展了多轮临床数据自查核查工作,对于未按规定撤回的问题申请人给予三年内不受理新申请的处罚。同时,总局将具有明显临床价值或针对特定病种的创新药、仿制药纳入优先审评审批。
出台一系列配套措施提高药品质量、鼓励药品创新。2016年3月4日《化学药品注册分类改革工作方案》出台,对化药的注册分类进行改改。同时试点药品上市许可持有人制度(MAH),实行药品上市许可与生产许可分离的管理模式,鼓励医药创新专业化。
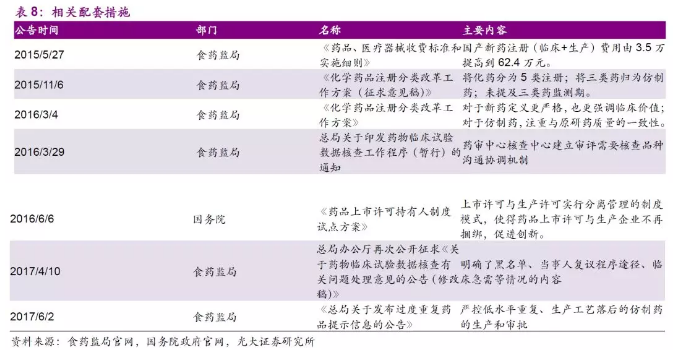
在国家政策的扶持和相关配套措施的执行之下,我国创新药产业加速发展,截至17年11月,已有创新药申报品种135个,创新药申报受理号354个。新药申报上市的速度也在不断加快。17年12月,信达生物向食药监局提交了其PD-1单抗(IBI308)的上市申请,按照治疗用生物制品1类新药申报,这是首个申报上市的国产PD-1抗体,仅次于百时美施贵宝的Opdivo,从申请临床到申请生产仅耗时23个月。
创新药物研发逐渐与国际接轨
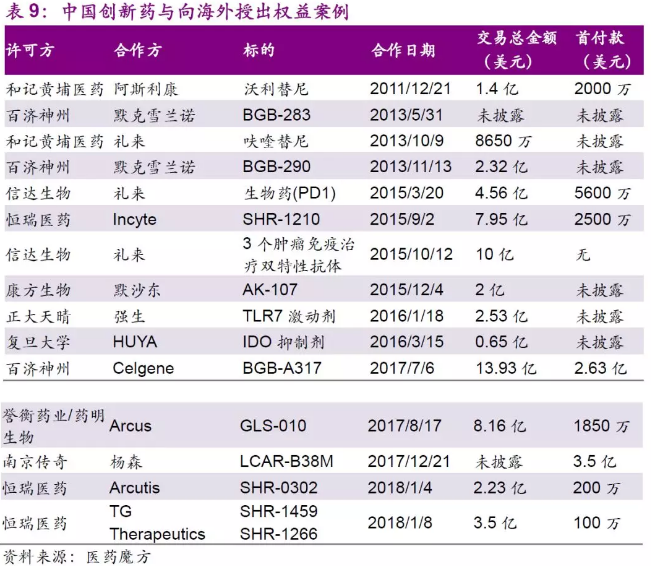
国产创新药海外授权增多。国产制药企业自主研发的药物授权海外企业进行推广、销售的案例也越来越多。
从许可方角度,包括和记黄埔、百济神州、信达生物等企业与跨国大型药企达成授权协议的案例越来越多,涉及到的交易总金额也十分高昂。例如,17年12月22日, Janssen Biotech与港股上市公司金斯瑞生物科技子公司南京传奇达成协议, Janssen将支付给公司3.5亿美元的先期资金,以多发性骨髓瘤为适应症,获得在全球共同开发和推广CAR-T品种(LCAR-B38M)的许可。随着开发与商业化等里程碑的到来,Janssen将提供额外的里程碑资金。
从合作方角度,与和记黄埔合作的阿斯利康、与信达生物合作的礼来等均为全球大型医药公司,在研发、推广领域经验丰富。这样的合作越来越多也标志着国际知名药企对中国创新药研发的认可,未来中国的创新药物将进一步与国际接轨产生更大的影响力。而采用收购的形式获得新的产品线也将增强、拓宽这些公司的核心业务。
引进海外药企的品种并挖掘市场潜力等新型模式开始出现。此外还有一些药企引进国外药企的一些品种进行后续开发以挖掘国内或国际市场潜力。于美股上市的再鼎医药就是这样一家以License in+CRO新型药物开发模式的小型研发型药企。主要从事肿瘤、自身免疫、传染性疾病药物研发,但雇员人数仅52人。公司的领先在研新药之一ZL-2306是与美股制药公司Tesaro达成合作协议,获得推进创新PARP抑制剂在中国的研发和销售权益。公司还从ParatekPharmaceuticals获得ZL-2401,从百时美施贵宝公司获得ZL-2301丙氨酸布立尼布片。

根据IMS Health(艾美仕)显示,2015年美国医药市场规模是4390亿美元,美国医药市场将以年均5.6%的速度增长,预估2020年后这个数字将会升至5800亿美元,从药品结构来看,美国创新药占比将稳定在66~67%。中国目前药品结构仍以化学药制剂为主,医药消费市场规模到2020将达到1650亿美元,而创新药的市场规模将约有翻倍的增长。我们认为未来几年创新药领域的研发趋势还将不断持续,国内制药产业核心将向创新药转移。从长远看,创新药研发的沃土将会孕育具有强大研发能力和新产品不断上市的制药巨头。
港股研发型药企估值:从PEG走向PEG+Pipeline
港股将允许未盈利生物科技上市
17年12月15日,港交所旗下联交所公布决定落实计划拓宽现行的上市制度,主要将在《主板规则》新增两个章节,包括容许尚未盈利或未有收入的生物科技发行人,或者是不同投票权架构的新兴及创新产业发行人,在作出额外披露及制定保障措施后在主板上市。对生物科技企业的具体的业务要求有:1、仅限生物科技公司,预期最低市值不得少于15亿港元;2、拥有至少一种已通过概念开发流程(如美国食品和药物管理局的一期临床试验);3、曾有至少一名资深投资者进行投资;4、具备125%营运资金,至少在上市前两年主要从事现有业务。
纳斯达克此前为研发型药企上市首选
此前,中国的一些小型以研发驱动的生物技术药企如百济神州、和记黄埔、信达生物等企业在A股很难有机会上市,因此选择未上市或在美股上市。
百济神州成立五年美股上市。百济神州(BGNE)是一家全球性的生物制药公司,成立于2010年,致力于成为具有创新性的分子靶向与免疫抗肿瘤药物研发领域领导者。公司2016年2月3日在美国IPO,并于4月21日在美国纳斯达克敲响开市钟。彼时,成立仅5年的百济神州尚无产品上市,公司一直处于亏损的营业状态,但是作为首个赴美上市的中国创业型生物制药企业,上市首日总市值达到7.2亿美元。公司选择在美国上市主要目的之一是募集研发资金,更为重要的一方面则是美股允许未有盈利的生物技术公司上市,并且国外投资者对无产品、专注研发并需要大量资金投入的初创生物制药研发企业接受度更高。
信达生物成立于2011年8月。2015年,信达两次与美国礼来达成全面战略合作,获得首付及潜在里程碑款等33亿美元。信达生物已经建立起一条包括10个新药品种的产品链,适应症覆盖肿瘤、眼底病、糖尿病、自身免疫疾病等领域。现已成功获得8项临床研究批件。公司研发的抗PD-1单抗已经提交新药上市申请,有望在今年上市。

新规或将吸引更多生物科技公司赴港股上市
港股对未盈利生物技术企业的市场开放是香港市场近二十多年来最为重要的一次上市改革,新规有望于2018年下半年落实,长期来看有助于更多生物技术创新型公司在港股上市,刺激生物科技领域的投资行为,为投资机构和企业带来新的机遇。
根据清科研究中心的统计,17年完成上亿元人民币投融资的有3家企业属于生物制药领域。而17年度获得融资的项目多为生物药、创新药等,新药投资热度不减。我们认为18年将会有更多的中国药企在全球主流资本市场上市。考虑到美股企业估值普遍偏低,港股较美股有更为理想的估值,较A股有更为理想的海外并购条件,新规落实后将吸引国内优秀的研发型药企赴港股上市。

估值方法哪种更为合适?
风险修正的现金流折现法(rNPV法)更为适合
美国生物制药界及风投界应用较多的有成本分析法(cost-basedmethod)、市场分析法(Market Comparables)、实物期权法(Real options)和现金流贴现法(DCF法)。
成本分析法(cost-based method)指通过计算研发项目已经发生的成本来进行估值,优点是使用简单方便,缺点是新药研发周期较长、同时在研发各个阶段中断的可能性也较大,运用成本分析法忽略了项目的风险性。
市场分析法(Market Comparables)指参考市场上类似的研发项目,对已有的市场数据作为参考并进行调整,得到研究项目的成本估算,优点是较为简单,缺点是没有考虑研发项目的独特性和差异性。
实物期权法(Real options)是将新药研发看成一系列根据研发项目的阶段性结果进行选择的过程,项目的价值是NPV和实物期权值之和。优点是可以规避一定的风险,缺点是适用于新药研发项目价值的估算,但不适用于已实际发生的成本费用的估算。
现金流贴现法(DCF法)是运用最广泛的成本估算方法,根据各个新药研发阶段得到的实际成本数据,通过CAPM法,选择适当的折现率,综合考虑资金的使用成本和机会成本,最后得到研发项目成本的净现值。DCF法优点是应用简单且被广泛认可,但缺点是将研发项目的成本投入看成是一次性的投资,没有考虑到技术风险。在实际运用中,一般将技术风险从折现率中独立体现出来,采用风险修正的现金流折现法(rNPV法)。
我们认为采用风险修正的现金流折现法(rNPV法)更适合于目前港股研发型药企在研管线的估值,我们引入药物上市成功概率P值对模型进行修正和调整。

该模型第一阶段为药物研发到专利到期前,通过对同类药品、适应症人群、患者支付能力、团队销售能力等进行分析对上市后现金流进行估算,第二阶段为专利过期之后的永续增长阶段,假设未来新药永续增长率为1~2%。最后将得到的药物价值乘以成功上市的概率,得到产品现阶段的价值。
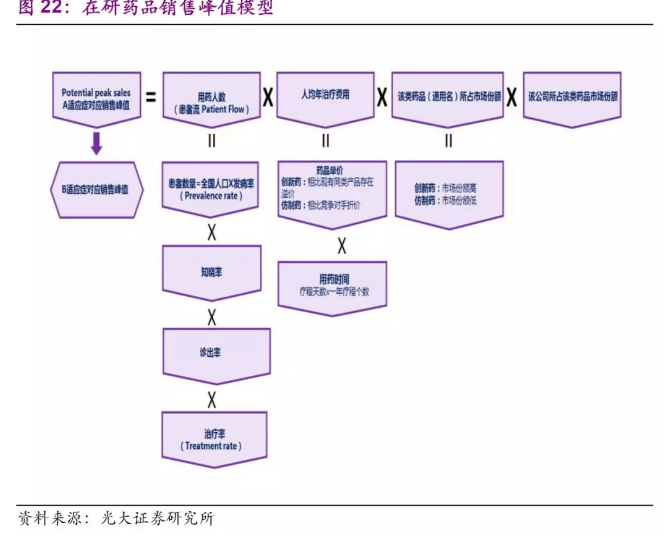
上市后现金流进行估算,我们需要建立疾病模型确定销售峰值、假设自由现金流比例、永续增长率、贴现率等。
在确定在研药品的销售峰值时,我们需要估算药品的用药人数,从药品的定价和用药时间估算人均治疗费用,估算在治疗该种适应症的各类药品中该通用名所能占据的市场份额和药品上市后该公司能占据该类药品的市场份额,将几个估算的数量相乘推算药品的销售峰值。销售峰值的推算需要考虑较多的因素,达峰的时间包括但不限于公司销售团队开拓市场能力、市场竞争情况、竞争药品和替代产品上市的情况、患者支付能力等等。
【案例分析】中国生物制药(1177.HK)在研重磅产品安罗替尼
我们主要针对离上市较近的处于III期临床或者申报NDA的品种进行分析,即预计于2020年之前能够获批,为公司贡献业绩的产品。
安罗替尼是一种口服的新型小分子多靶点 TKI,可强效抑制 VEGFR、PDGFR、FGFR 和 c-Kit 等多个靶点,具有抗肿瘤血管生成和抑制肿瘤生长的作用。安罗替尼用于晚期 NSCLC 三线治疗的III 期研究(ALTER 0303)效果良好。
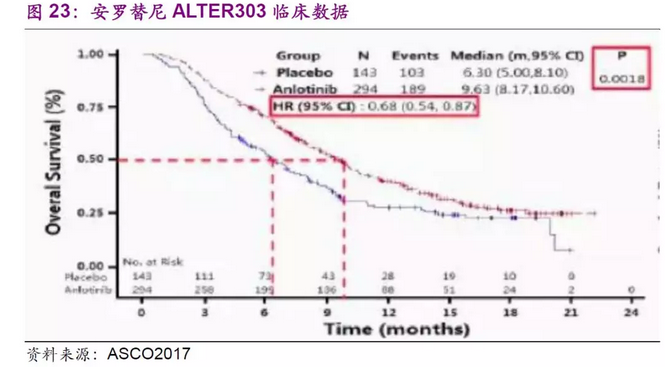
中国生物制药于 2017年3月递交安罗替尼的生产申请,适应症为3线治疗非小细胞肺癌,于4月获得优先审评资格,目前审评已经走到最后阶段,预计2018年1季度获批。根据公司在ASCO2017会议上的披露,研究成功达到主要终点。安罗替尼组患者的OS较安慰剂组显著延长3.33个月(9.63 个月对 6.30 个月,P<0.05)。其中,6个月时安罗替尼组有70.62%的患者仍生存,生存率较安慰剂组高17.8%。基于目前的进展,我们估算安罗替尼上市的概率P=1。
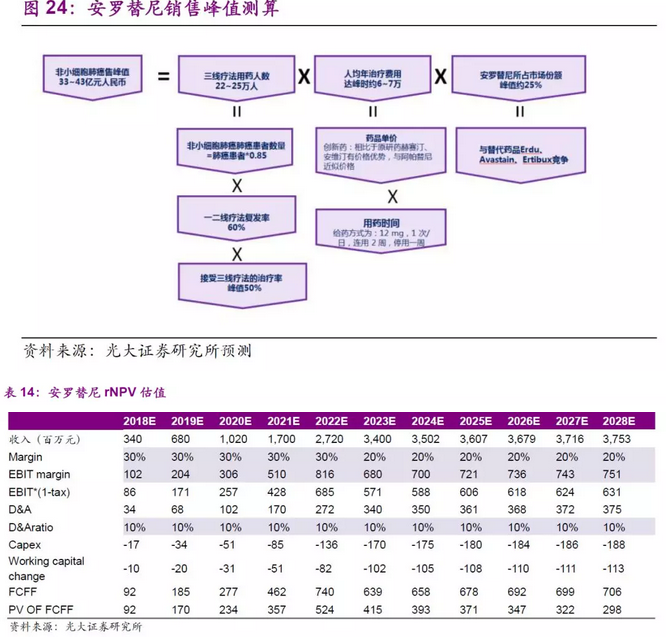
药品定价方面,我们认为安罗替尼的可参考药品有治疗胃癌III线疗法的阿帕替尼和治疗肿瘤的原研药物如赫赛汀和安维汀等,报销比例约为70%,我们预计上市之初用药患者年治疗费用约为10~15万元人民币,随着药品竞品上市和降价等因素,预计5~6年达峰时价格约为6~7万元人民币。
考虑到中国2016年目前肺癌人群73.7万人,非小细胞肺癌约占85%,我们假设接受一线和二线治疗复发的患者占60%,假设接受三线疗法的患者占比50%,三线疗法的用药中,我们预计安罗替尼可以逐步占据25%的市场份额。
综合考虑,我们认为安罗替尼上市之后5~6年可以达到销售峰值约为33~43亿人民币,此外,公司也在积极拓展其他适应症的使用,以及也在准备 3 线治疗推进到 2 线治疗的临床实验。我们的估算中尚未考虑其他适应症和其他适应症外用药带来的销售收入。我们认为安罗替尼将是中国生物制药未来产品线中非常重磅的一个产品。
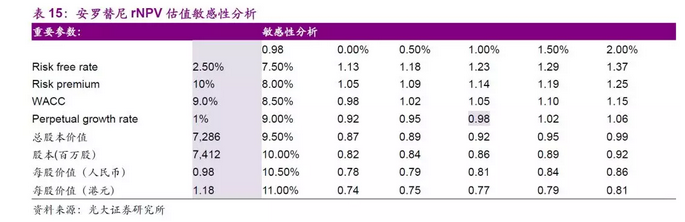
其他考量因素
药物研发成功与否是0与1的博弈,药物研发的失败率之高让我们对在研管线的估值,不同药物在不同的临床阶段成功上市的概率也不一样,因此需要密切跟踪公司的在研药物的临床进展以不断修正模型。
中国药品市场尚不成熟,药品销售生命曲线的跟踪也显得尤为重要。在本次报告的模型搭建中主要借鉴了国外新药上市之后达到销售峰值的年限约为5-6年来做估算和预测,在实际的药品销售中,如石药集团的恩必普,随着注射剂剂型的上市,将药品的销售又推向了新的峰值,达峰时间则长于5-6年。考虑到剂型、新适应症的拓展、适应症外用药等等因素,也需要密切跟踪药品销售数据以不断修正模型。
药品价格的波动也影响对在研药品的估值,医保控费、患者支付能力、仿制药上市之后的价格波动等都需要在后续的跟踪中不断改正修正模型。
投资标的:创新研发型企业在研管线重估
国内向创新药转型的公司越来越多。我们可以看到港股上市的药企中在研发方面的投入逐年增加,药企的研发费用率也逐年上升。研发投入是制药企业的未来,我们认为未来一定会有一批以研发为导向的小型制药公司或新药研发产业链相关的公司在港股上市,也会有部分传统企业加大研发投入谋求转型。医药企业估值体系从PEG估值走向PEG+在研管线折现估值,对港股现有的研发型药企的在研管线重新估值也显得尤为重要。我们对港股6家研发型药企的在研品种中处于较为后期阶段的品种进行了梳理,并进行了峰值预测和现金流折现估值。
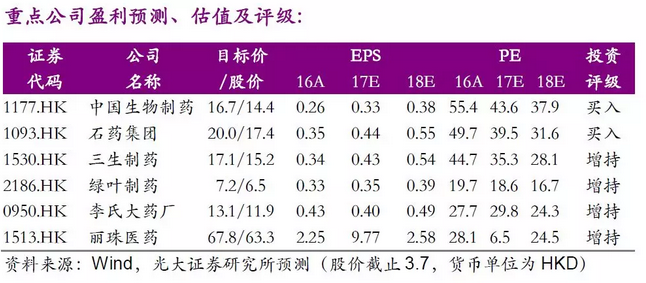
中国生物制药(1177.HK):港股研发标杆,在研管线雄厚
◆中国生物制药旗下的正大天晴是国内一线梯队里的优质药企,是港股研发型药企的标杆,16年的研发费用超过16亿港元,在国内药企中名列前茅。公司在各领域的研发布局全面并且进度领先,在肝病、心血管、抗肿瘤领域优势明显,整体研发、销售强劲。
◆从产品线来看,目前公司的产品领域治疗涉及肝病、肿瘤、呼吸、感染、消化等多种大病种领域,10多个年销售过亿元的产品形成了“亿元产品群”,其中年销售额超20亿元产品2个,分别为国家一类新药天晴甘美和国内首家上市的恩替卡韦分散片。抗肿瘤领域也形成了独特的产品线,血液肿瘤产品地西他滨、伊马替尼、达沙替尼国内首仿;实体瘤产品卡培他滨获批上市。
◆公司在创新药、仿制药储备方面十分丰富,累计有临床批件、临床中、报生产的在研产品超过400个,产品布局有序,创新药和仿制药并重,相对于国内大部分产品单一的化药企业来讲,公司将不断通过新产品脱颖而出。
我们梳理了公司目前的在研管线,对其中处于临床后期的重点品种进行了销售峰值预测。
Ø盐酸安罗替尼胶囊,有望于18年上半年上市销售,安罗替尼上市首年销售收入有望达到3亿元,销售峰值有望达到33~43亿人民币,此外,公司也在积极拓展其他适应症的使用,以及也在准备 3 线治疗推进到 2 线治疗的临床实验。我们的估算中尚未考虑其他适应症和其他适应症外用药带来的销售收入。我们认为安罗替尼将是中国生物制药未来产品线中非常重磅的一个产品。
Ø富马酸替诺福韦二吡呋酯片,有望于18年上市销售,药品于17年底获批乙肝适应症,预计18年销售额约为2亿元,销售峰值将达到15~20亿元。16年乙肝病毒用药市场规模约为150亿元,预计替诺福韦达峰时可以达到20%以上的份额,估算中国生物制药的替诺福韦产品可以占据约50%销售份额。
Ø沙美特罗替卡松,产品有望于2019年上市,预计销售峰值约为10亿元。沙美特罗替卡松粉吸入剂为联合用药形式(支气管扩张剂和吸入皮质激素),用于可逆性阻塞性气道疾病治疗。
Ø苹果酸卡博替尼胶囊,产品有望于2019年上市,预计销售峰值约为6亿元。卡博替尼是MET、VEGR2、RET、ROS1、AXL、KIT、TIE-2等多靶点靶向药,这些靶点对于肿瘤发生、转移、血管生成和微环境维持等有一定的相关性,卡博替尼年治疗费用高昂约在人民币10~20万元。
Ø来那度胺,产品有望于2018年上市,预计18年销售额约1亿元,我们预计销售峰值约为10亿元。来那度胺适应症为多发性骨髓瘤,原研瑞复美为新基公司重磅产品,2016年全球销售额69.7亿美元,中国来那度胺销售规模可达百亿,17年2月双鹭药业来那度胺作为首仿上市预计可以占据50亿销售额。
◆目标价16.7港元,维持“买入”评级:考虑到收购北京泰德和发行股份的影响,我们调整公司2017-2019 年的净利润预测为24.7/31.6/36.7亿港元,调整17~19年EPS为0.33、0.38 和0.44港元,当前股价对应PE为43/38/33x,采用分部估值法对公司的现有及在研管线分别估值,目前港股医药板块平均估值水平为对应18年23倍,现有产品组合丰富、市占率高,公司为国内肝病用药龙头企业,对现有产品给予18年30倍,对应每股11.6港元,在研核心产品通过rNPV折现得到每股价值约5.1港元,给予公司目标价16.7港元,隐含2018年44倍PE,维持“买入”评级。
◆风险提示:招标价格压力,审批政策风险。
石药集团(1093.HK):原料药厂商向高端创新药厂商迈进
◆石药集团是国内领先的大型综合性制药企业,主营成药和原料药两大产品线,成药业务板块又分为创新药板块和普药板块,其中公司创新药成为发展的主要动力,公司已经从原料药企业成功转型成高端创新药生产商。
◆公司现有的核心产品恩必普积极开拓空白市场、渠道下沉,维持30%以上高速增长,其中注射剂剂型纳入新版医保空间广阔; 抗肿瘤产品群逐步形成,进入高速增长期:抗肿瘤产品人民币多美素、津优力保持高速增长。肿瘤销售团队增速较快。公司加大了对代理商学术推广的力度,效果开始逐步显现。预计17/18年抗肿瘤产品将成为公司第二增长点,有望实现60%以上高速增长。
◆研发与并购双轮驱动:公司原料药业务方面维C、咖啡因业务经营溢利增长迅速。公司利用这块业务改善的利润投入到研发和并购方面,预计17年累计投入6-7亿元。18年1月公司收购武汉友芝友双抗平台,进军生物药领域。公司目前拥有超过70个在研品种,我们梳理了公司的在研管线,对其中处于临床后期的重点品种进行了销售峰值预测。
Ø紫杉醇白蛋白有望于2018年上市销售。我们预计紫杉醇白蛋白18年销售额可达1亿元,销售峰值可达10亿元。紫杉醇属于细胞毒药物,多适应症,现约有30亿元市场,进入市场即与普通剂型、脂质体剂型共同竞争。
Ø盐酸米托蒽醌脂质体注射液,目前正在处于临床II期阶段,有望于2020年上市销售。我们预计米托蒽醌脂质体20年销售额可达1亿元,销售峰值可达10亿元。该产品为石药集团独家产品,米托蒽醌是临床上应用较广的广谱抗肿瘤药物,获得FDA孤儿药认证,享受七年市场独占。
Ø硼替佐米有望于2018年上市销售我们预计硼替佐米18年销售额可达5000万元,销售峰值可达5~8亿元。16年中国样本医院2.1亿元,约20家国产企业仿制注册申请中,石药有望成为首仿。
◆目标价20港元,维持“买入”评级:我们维持公司2017-2019 年的EPS为分别为0.44、0.55 和0.66港元,当前股价对应PE为40/32/26x。采用分部估值法对公司的现有及在研管线分别估值,目前港股医药板块平均估值水平为对应18年23倍,公司现有产品仍处于高速增长阶段,对现有产品给予18年30倍,对应每股16.5港元,在研核心产品通过rNPV折现得到每股价值约3.5港元,给予公司目标价20港元,隐含2018年36倍PE,维持“买入”评级。
◆风险提示:招标价格压力,原料药价格波动,审批政策风险。
三生制药(1530.HK)生物制药领头企业,产品逐步丰富
◆公司是中国生物制药领头企业,目前拥有七个生物产品,我们看好公司在生物药领域的长期发展。受益于新版医保目录调整,公司核心品种益赛普、特比澳、益比奥和赛博尔18年将进入发力增长期,有望较快形成突破10亿的产品群。公司在生物药领域布局领先且全面,随着核心产品的放量及新产品的逐步补充,生物药领先地位日益稳固。
◆公司积极布局糖尿病领域,分别收购GLP-1产品百泌达和百达杨,从目前我国糖尿病用药市场格局来看,两款产品市场渗透潜力大。此外,公司从礼来获得胰岛素产品优泌林在华分销和推广权。随着团队整合的推进,未来糖尿病业务的利润率有望提升至15-20%。公司与中信产业基金成立合营公司,将收购Therapure的CDMO核心业务,未来将会为公司的长期盈利提供增长点。
◆公司专注创新药、生物药的研发。截至17年6月,公司拥有25种在研产品,其中16种作为国家1类新药开发。
目前我们梳理了公司的在研管线,对其中可能于2020年之前上市的重点品种进行了销售峰值预测。
Ø注射用艾塞那肽缓释微球,进入快速审批通道有望于于18Q1获得销售批准,预计百达杨18年销售额将达到5000万元,销售峰值可达到3~4亿元。艾塞那肽缓释制剂作为血糖控制剂,每周只需皮下注射一次,百达杨16年全球销售额约5亿美元,普通艾塞那肽注射液(每日2次)16年中国销售额约1亿元人民币。
Ø注射用重组抗HER2人源化单克隆抗体,临床自查撤回的赛普汀第三方审查已经完成,剔除个别病例后完成重新申报。预计产品可能于19年上市,预计产品19年销售额将达到1.5万元,销售峰值可达到15~20亿元。曲妥珠单抗适应症为乳腺癌和胃癌,原研药为赫赛汀,我们预计中国曲妥珠单抗市场规模将超过 50 亿人民币,假设国产曲妥珠单抗占80%,则国产曲妥珠单抗销售规模可达40亿元。
Ø艾曲波帕,处于临床试验阶段,有望于2020年上市销售。预计艾曲波帕22年销售额可达5000万元,销售峰值可达10亿元。曲波帕适应症为特发性血小板减少性紫癜、丙肝、重型再生障碍性贫血。作为一款靶向药、孤儿药,在欧美价格昂贵。从艾曲波帕在美国价格来看,25mg30粒的价格约3000美元,我们预计艾曲波帕年治疗费用将超过十万元。
◆维持“增持”评级,目标价17.1港元:我们维持公司2017-2019 年的EPS分别为0.35/0.44/0.53元人民币,当前股价对应PE为35/28/23x,采用分部估值法对公司的现有及在研管线分别估值:公司作为生物药龙头企业,未来2-3年成长性确定,目前各个业务板块正在不断丰富中,对现有产品给予18年26倍估值,对应每股13.9港元;在研核心产品通过rNPV折现得到每股价值约3.1港元,给予公司目标价17.1港元,隐含2018年39倍PE,维持“增持”评级。
◆风险提示:研发进度不及预期,销售不及预期,CDMO客户流失。
绿叶制药(2186.HK):四大研发平台、整合全球资源
◆绿叶制药是一家以研发为导向的专业制药企业,目前有34 种上市产品,核心产品包括力扑素、希美纳、血脂康、麦纳通、贝希及卡巴拉汀贴片。2016 年公司在肿瘤科、心血管系统、消化与代谢系统及其他治疗领域的产品销售额同比2015 年分别增长12.5%、4.9%、18.4%及80.9%,总收入达29.18 亿元,同比增长13.8%。17年上半年,公司实现营业收入18.5亿元人民币,,同比增长24.2%,实现净利润3.85亿元,净利润率达到20.8%。总体看来,特色的产品组合及策略性的市场定位使得公司在日益激烈的市场竞争中脱颖而出。
◆布局全球市场,扩大市场覆盖。公司目前以集团化运营管理,销售推广方式以学术推广为主,销售网络覆盖全国,同时公司并购整合能强大,17年收购欧洲Acino子公司,获得了透皮制剂和植入体技术平台,切入中枢神经系统、疼痛等领域,17年下半年收购2个单抗产品。通过外延并购获得的产品可以和公司现有业务形成协同效应,同时也帮助公司打开了更大市场。
◆研发实力雄厚,四大平台在研管线丰富。公司海外研发产品拥有超过10个在研产品、其中5个在美国进入临床阶段,1个在欧洲进入临床阶段,中国在研产品线包括11个肿瘤药物、12个中枢神经药物和4个心血管代谢药物。梯队分布合理的在研产品线构成了公司在研发领域较强的核心竞争力,新产品也将成为公司未来的竞争力。
目前我们梳理了公司的在研管线,对其中处于临床后期的重点品种进行了销售峰值预测。
Ø注射用利培酮缓释微球: LY03004处于生产准备阶段,有望于2019年下半年上市销售。预计利培酮19年销售额可达2亿元,销售峰值可达20亿元。利培酮是用于治疗急性和慢性精神分裂症。目前市场上利培酮有普通型和长效型两种。普通剂型的利培酮需连续服用三周以维持血药浓度,患者依从性较差,注射用利培酮缓释微球使用了缓释微球技术,能更快达到稳态血液浓度,只需每两周注射一次。产品主要的竞争产品是强生公司的利培酮(原研药)和帕利哌酮注射剂,利培酮微球全球销售额约10亿美元。
Ø注射用罗替戈汀缓释微球,LY03003处于临床II期阶段,有望于2020年上市销售,预计罗替戈丁20年销售额可达1亿元,销售峰值可达10亿元。罗替戈丁用于治疗帕金森综合征,原有贴剂每日一次,绿叶新设计长效微球剂型,预期给药一周一次。根据IMS,16年全国实际PD用药销售额约在18亿元人民币。
Ø盐酸安舒法辛缓释片,LY03005处于临床II期阶段,有望于2021年上市,预计盐酸安舒法辛缓释片21年销售额可达1亿元,销售峰值可达10亿元。盐酸安舒法辛缓释片适应症为抑郁症,目前按国内1.1类新药申报。根据IMS16年全国抗抑郁药销售金额约在50亿元人民币。
Ø重组抗VEGF人源化单克隆抗体注射液,LY01008处于临床I期阶段,有望于2020年上市,预计盐贝伐珠单抗仿制药20年销售额可达1亿元,销售峰值可达10亿元。贝伐珠单抗仿制药适应症为结直肠癌和非小细胞肺癌。
我们预计公司17~19年营业收入为34.4/37.7/45.2亿元人民币,同比增长17.8%/9.7%/19.9%,其中肿瘤药物、心血管药物、消化与代谢药物、其他药物17年的增长率分别为15%、5%、30%、5%,Acino公司并表于17年也将为公司贡献收入。盈利方面,我们预计公司17~19年净利润为9.5/10.7/12.8亿元人民币,同比增长6.1%/13.1%/19.9%,净利润率分别为27.5%/28.4%/28.4%。
◆首次覆盖给予“增持”评级,目标价7.2港元:我们预计公司2017-2019年的EPS分别为0.29/0.32/0.39元人民币,当前股价对应PE为19/17/14x。我们采用分部估值法对公司的现有及在研管线分别估值:其中力朴素受省医保调整影响增速较为平缓,但贝希等二线品种处于快速增长的上升期,综合来看,已上市产品组合保持低增速增长,对现有产品给予18年13倍估值,对应每股5.1港元;在研核心产品通过rNPV折现得到每股价值约2.1港元。首次覆盖给予公司目标价7.2港元,隐含2018年18倍PE,“增持”评级。
◆风险提示:研发进度不及预期,并购企业业务不及预期
李氏大药厂(950.HK):研发与代理双轮驱动的国际化制药企业
◆李氏大药厂以研发创新为导向的优秀生物制药企业,公司以自主专利产品和代理进口产品为主,旗下共有8大核心品种。从17年前3季度的情况来看,17年第三季度营业收入同比增长7.3%,扣非净利润增速为3.9%,公司现有产品的销售已经逐步趋稳。
◆公司围绕心血管、肿瘤、眼科、皮肤科、妇产科、肾科六大领域有超过50个在研项目,在研产品含金量高,数个重磅产品有望于未来的48个月之内推出,成为公司未来业绩增长的强劲驱动力。
目前我们梳理了公司的在研管线,对其中可能于2020年之前上市及重点核心品种进行的销售峰值预测。
ØPexa-Vec,抗肝癌溶瘤免疫药物已进入全球3 期临床,有望于2020年上市销售。我们预计Pexa-Vec 20年销售额可达2亿元,销售峰值可达20亿元。Pexa-Vec适应症为肝癌,属于肿瘤生物免疫类药物,与索拉菲尼联用具有显著的临床效果。
Ø盐酸丙卡巴肼胶囊,处于临床III期阶段,有望于2019年上市销售。我们预计销售峰值可达2~3亿元。
Ø氟酸钠滴眼眼药水,处于新药临床申请阶段,有望于2020年上市销售,预计20年销售额可达2亿元,销售峰值可达15~20亿元。
Ø蛇毒抗血小板溶栓素(安菲博肽),处于临床II期阶段,有望于2020年下半年上市销售,预计20年销售额可达5000万元,销售峰值可达5亿元。安菲博肽适应症为急性冠状动脉综合症,脑卒中及血栓性血小板减少性紫癜处于临床前研究阶段。
Ø盐酸利多卡因粉末无针经皮注射给药系统,已经提交上市申请,有望于2018年上市销售,预计18年销售额可达5000万元,销售峰值可达5亿元。
我们预计公司17~19年营业收入为10.4/11.6/13.1亿港元,同比增长11.3%/12.4%/12.7%,其中专利药品和引进药品的收入增速分别为8.2%/10.4%/10.7%和14.1%/14%/14.3%。盈利方面,我们预计公司17~19年净利润为2.4/2.9/3.4亿港元,同比增长-6.7%/22.4%/16.8%,净利润率分别为22.7%/24.7%/25.6%。
◆首次覆盖给予“增持”评级,目标价13.1港元:我们预计公司2017-2019年的EPS分别为0.40/0.49/0.57港元,当前股价对应PE为30/24/21x。我们采用分部估值法对公司的现有及在研管线分别估值:现有产品组合走出低迷,将开始恢复稳健增长,对现有产品给予18年15倍估值,对应每股价值7.3港元;在研众多产品通过rNPV估值法每股价值5.8港元,首次覆盖给予公司目标价13.1港元,隐含2018年27倍PE,给予“增持”评级。
◆风险提示:研发进度不及预期,销售不及预期
丽珠医药(1513.HK):单抗、微球平台布局全面的创新药企业
◆丽珠集团作为中高端专科制药企业,目前已经在液体活检领域、细胞治疗领域、抗体药和基因测序几大领域都有布局,是国内为数不多的各个领域布局全面的公司之一,公司的特点在于销售和研发能力都较为强劲。公司17年前三季度实现营业收入65.21亿元,同比增加13.9%,净利润为42.5亿元,主要是转让旧厂房获得大额收益,预计增加公司净利润约35亿元,扣非净利润增速约22.1%。从前三季度的经营来看,公司目前营收保持稳健增长。
◆公司注重研发,在研平台主要有单抗和微球两个研发平台,为公司的在研管线提供持续驱动力。公司在单抗领域布局重点突出且进度处于国内药企前列。微球制剂平台具有较高技术壁垒目前研发竞争较小,预计未来产品线将平稳推出。
Ø注射用艾普拉唑钠,18年1月批准生产,有望于2018年年上市销售,预计销售峰值可达15亿元。注射用艾普拉唑钠属于丽珠专利药物,用于治疗胃食管返流症,艾普拉唑属于新一代PPI抑制剂(苯并咪唑类质子泵抑制剂),是我国消化领域唯一的创新药,其他拉唑类产品平均规模10亿以上。
Ø注射用重组人绒促性素,目前处于临床III期,有望于2019年上市,我预计销售峰值可以达到10亿元。国内人绒促性素规模超过1.5亿元,丽珠重组产品上市后,可以替代自己的尿源产品。
Ø注射用重组人源化抗人肿瘤坏死因子α单克隆抗体,目前处于临床II期,有望于2020年上市,预计销售峰值约5亿元。
Ø注射用重组人源化抗PD-1单克隆抗体,目前刚刚开始临床试验,我们预计有望于2022年之前上。PD-1/PD-L1是全球最热的靶点,属于免疫治疗,对肿瘤、抗感染、自身免疫性疾病和器官移植存活均有效,潜力巨大。目前国内约有20个(12个PD-1,8个PD-L1)以“PD-1/PD-L1”为靶点的药物正处于临床申报或者临床试验阶段。其中BMS、默沙东、恒瑞、信达的PD-1临床进度较快,预计18-19年上市。
我们预计公司17~19年营业收入为87.5/99.1/112.3、3亿元人民币,同比增长14.4%/13.2%/13.4%。中药制剂方面,参芪扶正增速放缓;化学制剂方面,受二胎政策影响,辅助生殖市场增长较快,公司二线品种促性激素将保持20%以上快速增长,亮丙瑞林微球等高速增长;诊断试剂、原料药等板块保持稳健增长。总体来看,公司的产品线梯队完善。
销售费用率、管理费用率、各项税率基本保持稳定,17年转让老厂房获得大额收益。盈利方面,我们预计公司17~19年净利润为44.3/11.7/14.3亿元人民币,同比增长464.7%/-73.6%22.3%,净利润率分别为27.5%/28.4%/28.4%。
◆首次覆盖给予“增持”评级,目标价67.8港元:我们预计公司2017-2019年的EPS分别为8.00/2.11/2.58元人民币,当前股价对应PE为7/25/20x。我们采用分部估值法对公司的现有及在研管线分别估值:其中核心品种参芪扶正增速放缓,但二线品种促性激素将保持20%以上快速增长,亮丙瑞林微球等高速增长,公司的产品线梯队完善,对现有产品给予18年21倍估值,对应港股医药板块18年平均估值水平,公司现有产品估值为每股价值54.7港元;在研产品通过rNPV估值法每股价值13.1港元,首次覆盖给予公司目标价67.8港元,隐含2018年26倍PE,给予“增持”评级。
◆风险提示:在研药品进度不及预期,招标降价压力,汇兑风险
风险分析
行业政策推出、落地执行不确定风险:15年以来行业政策密集发布,但政策落地执行的时间存在不确定性,未来相关政策的出台也存在不可预知的风险。
临床实验失败的风险:临床实验耗时久、投入大,临床实验失败尤其是重磅在研品种若不能上市对公司的长期发展将造成一定的风险。
研发进度不及预期的风险:研发进程的推进受到药审中心审评审批的影响,也受制约于临床试验的安排、患者招募等,研发进度并不能完全按照预期进行,仍存在研发不及预期的风险。
医保和招标降价风险:医保控费和招标都会导致产品上市之后的价格出现下降,产品价格下降速度过快对公司的盈利水平产生影响。
(编辑:文文)






