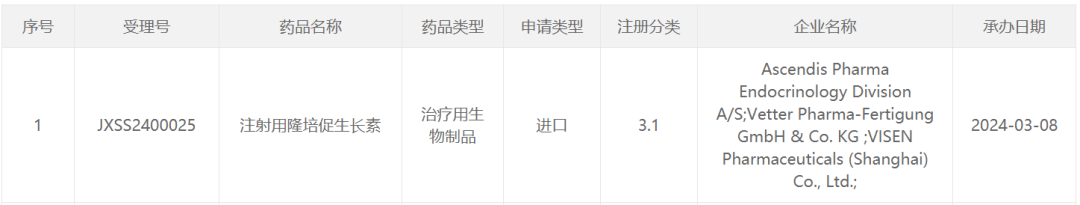
智通财经APP获悉,3月8日,中国国家药监局药品审评中心(CDE)官网公示,由Ascendis Pharma、维昇药业(VISEN Pharmaceuticals)申报的注射用隆培促生长素上市申请已获得受理。根据维昇药业新闻稿,隆培促生长素是一款长效生长激素(每周注射一次),用于治疗儿童生长激素缺乏症。
2022年11月,维昇药业宣隆培促生长素3期关键临床试验的主要研究数据。研究结果表明,隆培促生长素治疗52周后,年化生长速率(AHV)为10.66厘米/年。相比之下,生长激素日制剂治疗52周后的AHV为9.75厘米/年。这表明隆培促生长素非劣于生长激素日制剂。根据预设的统计检验,主要终点的分析结果也证实隆培促生长素优于生长激素日制剂。此外,多个预设的敏感性分析证实了结果的稳健性。安全性结果显示隆培促生长素耐受性良好,安全性特征与生长激素日制剂相当。
维昇药业首席执行官兼执行董事卢安邦表示,作为维昇药业首款即将商业化的产品,隆培促生长素中国3期临床结果已证实优效于生长激素日制剂。随着其上市申请获得受理,维昇药业迈出了走向产品商业化的重要一步。维昇药业将为中国内分泌患者带来更多全球前沿可靠的治疗方案。




