智通财经APP获悉,日前,强生(JNJ.US)宣布,美国FDA已批准其靶向B细胞成熟抗原(BCMA)的双特异性抗体Tecvayli(teclistamab)的补充生物制品许可申请(sBLA),用于将复发或难治性多发性骨髓瘤(RRMM)患者的给药频率降低为每两周一次(1.5 mg/kg),这些患者已达到并维持完全缓解(CR)至少六个月。此次批准为采用基于体重治疗方案的患者提供了更大的给药方案灵活性。
据悉,该批准主要基于MajesTEC-1临床1/2期试验的结果。在该研究中,患者最初接受每周一次推荐的2期剂量(RP2D,1.5 mg/kg)Tecvayli的皮下注射治疗。当患者达到确认CR达六个月以上时,则有资格将给药频率减少至每两周一次(1.5 mg/kg),直到疾病进展或出现不可接受的毒性。
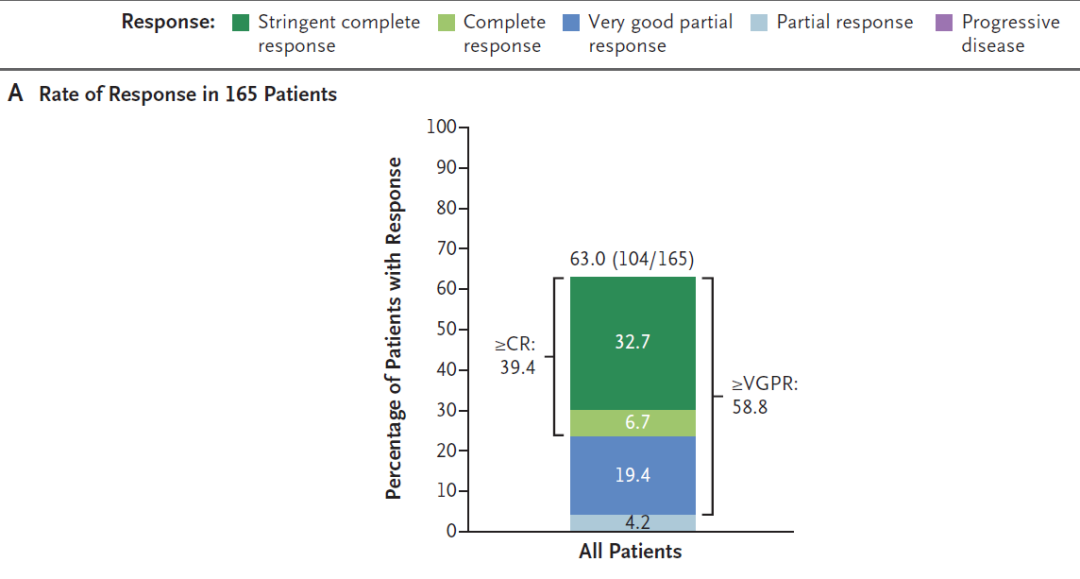
之前所公布的MajesTEC-1试验积极结果数据显示,在165名接受每周皮下注射teclistamab的RRMM患者中,总缓解率达到63%,值得一提的是,58.8%的患者获得非常好的部分缓解(VGPR)以上的应答,39.4%的患者获得完全缓解(CR)以上的应答。