智通财经APP获悉,据港交所9月30日披露,武汉滨会生物科技股份有限公司(简称:滨会生物)向港交所主板提交上市申请书,华泰国际、招银国际和中银国际为联席保荐人。

招股书显示,滨会生物是一家溶瘤病毒疗法生物科技公司,致力于创新癌症免疫疗法的发现、开发及商业化。公司旨在透过提供在疗效及安全性方面优于标准治疗的突破性溶瘤疗法,应对全球迫切未满足的临床需求。公司的工作由创始人兼董事会主席刘滨磊博士领导,彼于肿瘤免疫学及溶瘤病毒学领域拥有逾30年专业知识。刘博士为首个获FDA批准的溶瘤病毒药物IMLYGIC®(talimogene laherparepvec,或T-VEC)的塬研发团队的核心成员,并且在该药物的开发中发挥关键作用。
作为溶瘤病毒领域及其他领域的先驱,滨会生物已建立丰富且多元化的管线,包含五项处于不同开发阶段的产品,其中多项产品具有全球同类首创的潜力。公司自主研发的核心产品 BS001(OH2注射液)是一款基于II型单纯疱疹病毒(HSV-2)的新型溶瘤病毒候选药物,其生物学改造使其能够在肿瘤细胞内选择性复制,直接引发溶瘤效应,并分泌人粒细胞 — 巨噬细胞集落刺激因子(hGM-CSF)以激活全身免疫活动。公司目前正在研究BS001作为单药疗法及以主要药物作为联合疗法(尤其是与PD-1抑制剂联合用药),用于治疗多种实体瘤适应症,其中包括黑色素瘤、结直肠癌、胶质母细胞瘤、软组织肉瘤及胆道癌,而公司已在早期临床试验中观察到良好的安全性及初步疗效。
滨会生物的BS001为全球首个达到临床阶段并进入 III期关键试验的以HSV-2为病毒骨架的溶瘤病毒候选药物,有潜力成为全球首个获批准的以HSV-2为病毒骨架的溶瘤病毒疗法。BS001亦为首个获药品审评中心授予突破性疗法认定的溶瘤病毒候选药物。此外,BS001为首个及唯一一个获FDA授予孤儿药资格认定用于治疗III期至IV期黑色素瘤的中国塬创溶瘤病毒候选药物,以及首个获FDA授予孤儿药资格认定用于治疗恶性胶质瘤的中国塬创以HSV-2为病毒骨架的溶瘤病毒候选药物。
此外,BS001获FDA授予快速通道资格认定,用于治疗对抗 PD-1疗法耐药或在治疗后进展的不可切除的III期或IV期黑色素瘤。公司已将BS001推进至中国黑色素瘤III期临床试验,该试验为随机控制试验,显著采用主管监管机关认可的肿瘤学黄金标准疗效终点总生存期作为主要终点。其已完成的Ia/Ib期试验显示中位总生存期延长至31.06个月;然而,随着治疗持续进行中,最终总生存期尚未达到,并预期将继续延长。其亦呈报晚期黑色素瘤患者的客观缓解率为34.48%,而对PD-1疗法产生耐药性的患者的客观缓解率更高达42.1%。
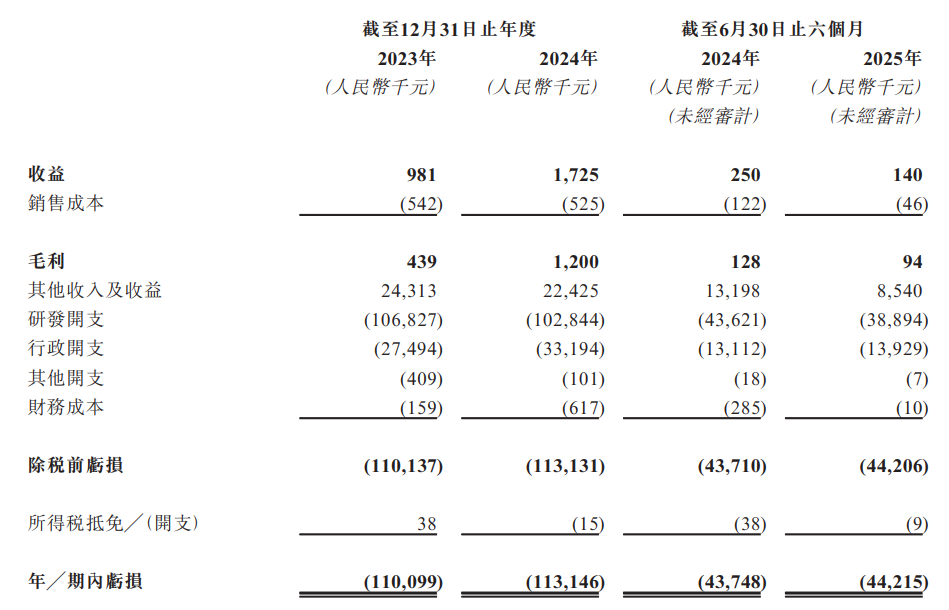
财务方面,于2023年度、2024年度、2024年及2025年截至6月30日止六个月,滨会生物实现收益分别为98.1万元、172.5万元、25万元、14万元人民币;同期,年/期内亏损分别为约1.10亿元、1.13亿元、4374.8万元、4421.5万元人民币。