智通财经APP讯,歌礼制药-B(01672)发布公告,该公司在2025年9月16日在奥地利维也纳举行的第61届欧洲糖尿病研究协会(EASD)年会上的简短口头讨论专场会议A中报告了其ASC30口服小分子GLP-1受体(GLP-1R)激动剂28天多剂量递增(MAD)研究 (NCT06680440)队列1和队列2的结果。
该Ib期MAD研究是一项在美国开展的随机、双盲、安慰剂对照的研究,旨在评估 ASC30每日一次口服片在肥胖受试者(体重指数(BMI):30-40 kg/m2)中的安全性与耐受性、不同剂量递增方案、药代动力学(PK)特征及初步疗效。
在MAD队列2(2毫克、10毫克、20毫克和40毫克,每周剂量递增)中,ASC30 每日一次口服片显示,经28天治疗后,安慰剂校準后的相对基线的平均体重下降6.5%。在MAD队列1(2毫克、5毫克、10毫克和20毫克,每周剂量递增)中, ASC30每日一次口服片显示,经28天治疗后,安慰剂校準后的相对基线的平均体重下降4.5%。第29天未观察到减重平台期迹象。
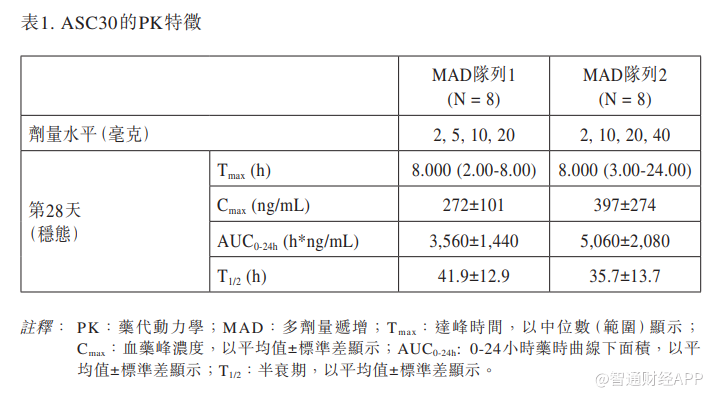
20毫克和40毫克ASC30在稳态时显示出更优的口服PK特征。更高的药时曲线下面积(AUC)与更显著的体重下降呈正相关。表1总结了ASC30的PK特征。
ASC30安全性和耐受性良好,仅出现轻度至中度胃肠道(GI)不良事件(AE)。在28 天治疗期及7天随访期内,MAD队列1(2毫克、5毫克、10毫克和20毫克)的呕吐发生率为零。虽然MAD队列2(2毫克、10毫克、20毫克和40毫克)发生了呕吐事件,但大部分发生于10毫克剂量递增周期间,且在2毫克剂量递增周未报告呕吐事件。综上所述,数据表明从2毫克逐周递增至5毫克是一种适宜的递增速度,并为IIa期研究设计的剂量递增方案提供了关键依据。
未有报告严重不良事件(SAE),也未观察到3级或以上AE。包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)和总胆红素(TBL)在内的肝酶在治疗期间均未升高。实验室检查、生命体征、ECGs(心电图,包括按心率校正的QT间期 (QTc))和体格检查均未发现异常。




